- A+
全球首款IDH1抑制剂上市这个消息被掩盖了!

没关系,

下面,我们一起来回顾下!
2017年8月2日-2018年7月21日,仅一年时间,两款针对IDH2/1基因突变的靶向药陆续获批上市,这也是FDA唯一批准的两款肿瘤代谢药物。详见:靶向治疗丨首款针对急性髓系白血病IDH1:p.R132突变的靶向药今日获批!
肿瘤代谢现在是和免疫疗法并行的一个主要治疗肿瘤研发方向。由于肿瘤细胞与正常细胞的生活方式不同,所以能量的摄取和利用与正常细胞也有所不同。
今天我们来聊聊IDH1和IDH2这两个肿瘤分子标志物!

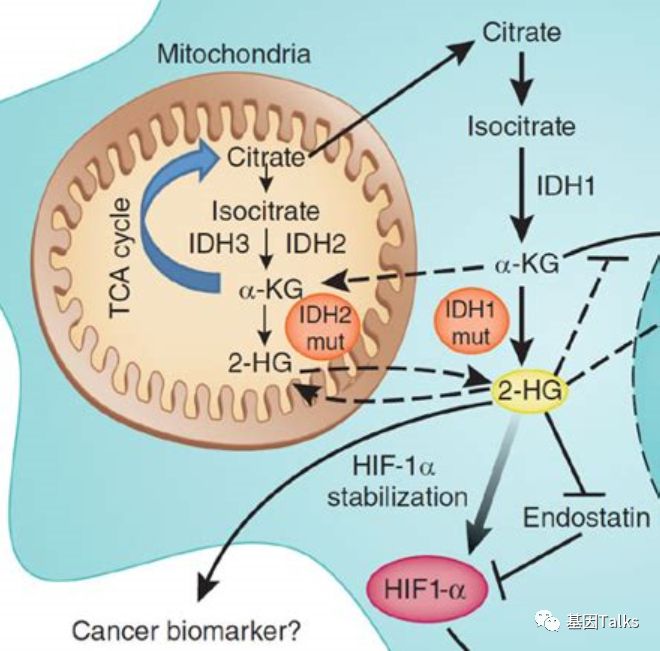
IDH1和IDH2编码异柠檬酸脱氢酶1和2,催化异柠檬酸氧化脱羧成ɑ-酮戊二酸(α-KG)[1,2] ,IDH1/2是人类肿瘤中代谢基因(metabolic genes)发生突变频率最高的,并干扰细胞新陈代谢和表观遗传调控,从而促进肿瘤发生。

IDH1/2变异,不仅失去了原有正常的催化功能,还获得了一个新的催化功能,能催化酮戊二酸到羟基戊二酸(2-HG)的转化。而2-HG抑制一些表观遗传氧化酶,造成基因表达异常而诱发肿瘤发生。IDH1/2抑制剂通过减少羟基戊二酸(2-HG)的异常生成,导致恶性细胞分化。

✦ 在新发现的急性髓细胞性白血病(AML)中[2], IDH1/2突变与正常的核型,更大的年龄及NPM1的突变有关。IDH2 R140Q突变最常见,但是对患者的生存率方面无任何影响或有利的影响,而IDH2 R172K突变则与患者预后较差相关(即生存率下降,复发率较高)。同时,IDH1/2突变与TET2突变相互排斥。
✦ 大多数WHO II/III级弥漫性胶质瘤和一些4级胶质母细胞瘤会携带IDH1 R132或IDH2 R172突变,并且通常具有良好的预后(即独立于等级或子类型,存活期较长)[1]。

急性髓细胞性白血病(AML),急性B淋巴细胞白血病,软骨类肿瘤,软骨肉瘤,脑胶质瘤,肝内胆管细胞肿瘤,遗传性嗜铬细胞瘤。
罕见病例:膀胱肿瘤,乳腺肿瘤,结直肠肿瘤,食道肿瘤,肺Ca,黑色素瘤,前列腺肿瘤,甲状腺肿瘤。

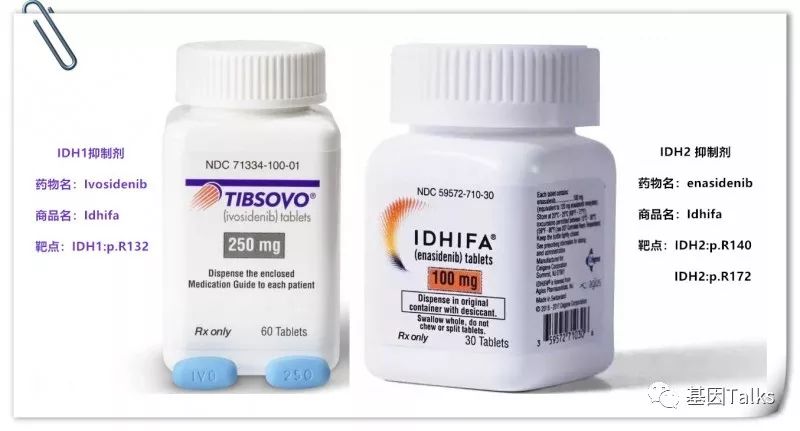
✦ Enasidenib[3]
商品名Idhifa,曾用名AG-221,用于治疗IDH2突变的成人复发/难治性急性髓细胞性白血病(AML),同时批准了雅培的RealTime IDH2 Assay作为伴随诊断试剂盒。
✦ Ivosidenib[4]
商品名Tibsovo,曾用名AG-120,用于治疗IDH1突变的成人复发/难治性急性髓细胞性白血病(AML),同时批准了雅培的RealTime IDH1 Assay作为伴随诊断试剂盒。

✦ 对于AML患者,应在开始使用Ivosidenib治疗前进行IDH1突变检测,在开始使用enasidenib治疗前进行IDH2突变检测。
✦ 在对弥漫性胶质瘤患者进行风险评估时,确定IDH1或IDH2突变(类型)可以提示更长的生存期。
✦ IDH1/2的检测包括评估DNA序列以及突变蛋白(存在)等各种方法。 同时,NGS检测分析方法现在也可用于IDH1/2的检测。

检测:雅培 RealTime IDH2 Assay伴随诊断试剂盒;
检测内容:PCR qualitative detection of single nucleotide variants encoding 9 IDH2 mutations: R140Q, R140L, R140G, R140W, R172K, R172M, R172G, R172S, and R172W;
样本类型:从血液或骨髓中分离出的DNA;
适应条件:AML患者考虑使用Enasidenib进行治疗。
检测:雅培 RealTime IDH1 Assay伴随诊断试剂盒;
检测内容:PCR qualitative detection of single nucleotide variants encoding 5 IDH1 mutations: R132C, R132H, R132G, R132S and R132L;
样本类型:从血液或骨髓中分离出的DNA;
适应条件:AML患者考虑使用Ivosidenib进行治疗。

IDH基因是脑胶质瘤的重要驱动基因,尤其在WHO II/III级胶质瘤和一些4级胶质母细胞瘤中突变频率较高,针对IDH突变抑制剂的研制和用于胶质瘤的治疗也在不断尝试中。
对于脑胶质瘤而言,IDH1/2抑制剂的有效性仍处于不稳定的状态,其原因目前尚不明晰:
✦ 可能由于血脑屏障的阻隔;
✦ 可能IDH突变诱导的表观遗传变化的可逆性在不同组织类型中有一定差异;
✦ 可能IDH在胶质瘤的疾病进展中从驱动突变转变为伴随突变等。
这些因素都可能使得IDH1/2抑制剂难以在脑胶质瘤中发挥作用。

1. Yang H, et al. Clin Cancer Res. 2012;18:5562-5571.
2. Mondesir J, et al. J Blood Med. 2016;7:171-180.
3. Stein EM, et al. Blood. 2017;130:722-731.
4. DiNardo CD, et al. ASH 2017. Abstract 725.