- A+
T790M基因突变检测的背景与意义
表皮生长因子受体-酪氨酸激酶抑制剂(epidermal growth factor receptor-tyrosine kinase inhibitors, EGFR-TKIs)已经成为NSCLC的有效靶向治疗药物,能够显著降低疾病进展或死亡风险,改善患者生存质量。然而,几乎全部EGFR基因突变患者在接受EGFR-TKI治疗后均会发生耐药,约60%患者由于T790M突变导致耐药发生[1,2]。国内外权威指南均强调EGFR-TKI治疗耐药后应尽进行T790M突变检测[3,4,5]。近些年,以血液等为样本基础的液体活检技术飞速发展,通过血浆循环游离DNA(cell free DNA, cfDNA)检测EGFR等基因突变具有显著优势,尤其适用于肿瘤标本不可评估(较难通过手术或穿刺获得肿瘤组织)的患者,并在一定程度上有效克服肿瘤异质性,可实现无创实时动态检测等。T790M血液检测与组织检测可相互补充验证,避免假阴性结果,提高检出率,使患者获益。在实际血液检测操作过程中,各步骤的规范化处理与否对检测质量影响巨大。为提高EGFR/T790M血液检测质量,特制订本血浆EGFR/T790M 基因突变检测标准流程,以供参考使用。
T790M基因突变检测流程
血液采集→血浆分离与质控→血浆运输与储存→ctDNA 提取、定量、储存→EGFR 突变检测→检测报告
第一章:血液采集、储存、运输
1.采血管
采血管常见有两类:
(1)cfDNA专用常温采血管:特指Streck Cell-Free DNA BCT® Blood Collection Tubes (10ml) , 后文中用Streck cfDNA常温采血管或Streck管指代。
(2)EDTA管
禁用肝素抗凝管:由于肝素使得DNA抽提得率降低并在DNA提取过程中难以去除,肝素也会导致PCR效率降低,因此cfDNA检测血液采集禁用肝素抗凝管。
2. 使用Streck cfDNA常温采血管采集、储存、运输血液
(1) 血液采集操作流程:
1). 依据 CLSI H3-A6 指南或当地指南采集静脉血
防止回流: 由于Streck 管含有化学添加物,必须避免血液回流。为防止回流,应采取以下措施:
a. 在采血过程中保持患者胳膊处于下方
b. 保持采血管和管塞处于上方,防止采血管管内容物触及管塞或针的末端
c. 在血液开始流入采血管时立即或在两分钟内释放止血带
2). 遵循 CLSI H3-A6 或当地指南或实验室准则采血
3). 采集10ml血液,完全填满采血管
4). 从适配器上取下采血管,握住采血管,立即轻柔颠倒10次。颠倒不充分或颠倒不及时均可能导致提取结果欠佳。一次完整颠倒包含手腕完全旋转180度再折回,如下图所示:
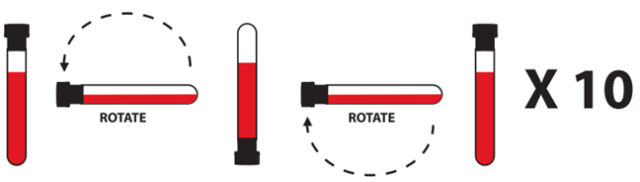
图 1采血管颠倒混匀
(2)血液储存及运输
为保证后续血浆分离及cfDNA提取质量,Streck管禁止冷藏/冷冻血液标本,建议常温保存及运输(6-36℃)至指定实验室。从采血至运输到实验室检测的时间间隔不超过3天。
3. 使用EDTA管(10ml) 采集、储存、运输血液
(1)遵循标准静脉采血程序采集10ml血液, 轻柔颠倒6-8次以混匀标本,切勿摇晃.
(2)禁止冷冻血液标本,建议4℃保存。
(3)血液应尽快离心处理,1小时内处理最佳,至多不超过2小时。本操作流程包括两步离心,以防止最终样本中出现基因组DNA/RNA污染。
4. 采血量的要求
(1)不同平台对血浆量的要求量不一样,一般要求采用 10mL 采血管,10ml 血液大约能分离出 4-5ml 血浆。
(2)对同一患者,血浆量越多,所提取的DNA量就越多,其中含有的 cfDNA量也就越高,对检测越有利
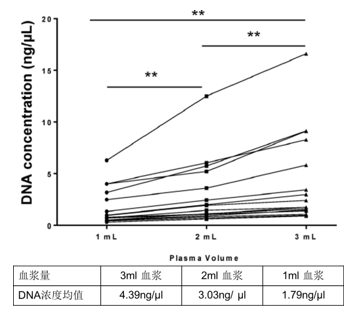
图 2对同一患者,血浆量越多,所提取的DNA量就越多,其中含有的 cfDNA量也就越高(Sherwood et al. 2016 PLoSONE)
5. 血液采集后送到实验室检测所能允许的最大时间间隔
(1)两小时内处理标本能最大程度避免血细胞破裂而造成基因组DNA (gDNA) 污染
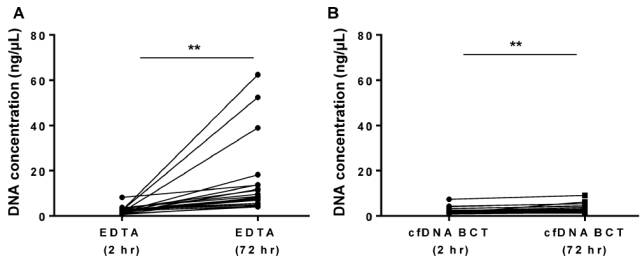
图 3 A. 2h 内处理标本,不论采用 EDTA管还是 cfDNA BCT 管,DNA浓度均无显著差异; B. 72h 内处理标本,不论 EDTA管还是 cfDNA BCT 管,DNA 浓度较 2h 时均显著提高,即 gDNA 污染增加(Sherwood et al. 2016 PLoSONE)
(2)不能在两小时内处理标本时,cfDNA BCT(Streck)管 优于 EDTA 管
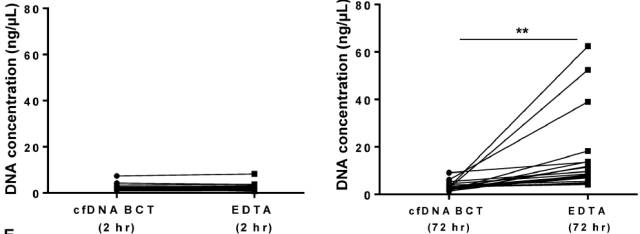
图 4 左图,2h 内处理标本,EDTA管和 cfDNA BCT 管无显著差异; 右图,72h内处理标本时,EDTA 管DNA浓度显著高于cfDNA BCT 管,即 EDTA 管中 gDNA 污染显著高于 cfDNA BCT 管(Sherwood et al 2016 PLoSONE)
(3)不同采血管所能允许的最大时间间隔
1)Streck 管:从采血至运输到实验室检测的时间间隔不超过3天。
2)EDTA 管:强烈建议在医院离心,分离出血浆之后干冰运输至实验室。从采血至分离血浆至多不能超过2小时。
6. 血液采集后送往实验室检测前的保存方式和条件
(1)Streck 管:血液应该在室温(6℃-36℃)储存,在室温(6℃-36℃)环境下运输至实验室。
(2)EDTA 管:从采血至运输到中心实验室离心处理至多不能超过2h,离心前临时保存应暂放于2~8℃冷藏。分离血浆后,应立即竖直放置,冷冻血浆,-80℃冷冻最佳(或-20℃冷冻直至干冰运输)。
第二章:血浆分离、储存与质控
1.血浆分离-Streck cfDNA常温采血管
Steck管血液应室温储存,在室温环境下(6-36℃)运输至指定实验室,实验室应在标本到达当日处理血液
(1)离心Streck 管:1600 ×g,10min,室温(使用水平转子)
(2)吸出血浆层(约4-5ml血浆),注意不要触及淡黄色薄层(在枪尖和淡黄色薄层之间留出5mm空隙),转入4个 1.5-2ml 离心管。
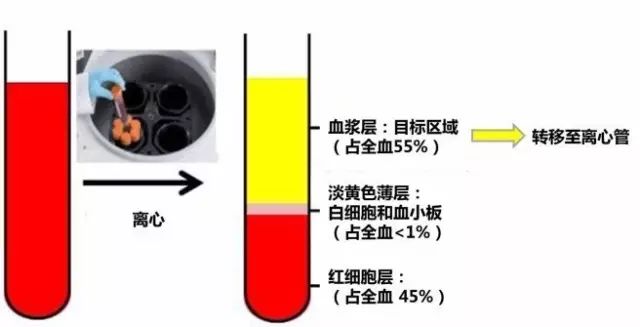
图 5 抽取上清
(3)离心:1600×g, 4℃, 10min
(4)吸出血浆层,切勿触及残渣,转入5 个小离心管中,每管转入1ml。
(5)立即竖直放置,冷冻血浆,-80℃冷冻最佳(或-20℃冷冻直至干冰运输)。
(6)使用试剂盒抽提cfDNA之前,建议再一次离心:16000×g,4℃(使用角转子)。用于去除残留的细胞碎片。
2.血浆分离-EDTA管
使用EDTA管血液应按照如下程序尽快处理,1小时内处理最佳,至多不超过2小时。本操作流程包括两步离心,以防止最终样本中出现基因组DNA/RNA污染。
(1)离心:2000×g,4℃,10min
注意:请确保离心机的减速装置处于OFF状态,以避免(在离心后因减速过快而)破坏淡黄色薄层。
(2)吸出血浆层(约4-5ml血浆),注意不要触及淡黄色薄层(在枪尖和淡黄色薄层之间留出5mm空隙),转入15ml离心管
(3)离心:2000×g,4℃, 10min
(4)吸出血浆层,切勿触及下方非血浆层,转入5 个小离心管中,每个转入1ml
(5)立即竖直放置,冷冻血浆,-80℃冷冻最佳(或-20℃冷冻直至干冰运输)
(6)使用试剂盒抽提cfDNA之前,建议再一次离心:16000×g,4℃(使用角转子)。用于去除残留的细胞碎片。
3. 采样质量评价
(1)离心后溶血:
严重溶血下,标本不可用,血红蛋白及其代谢产物可能抑制Taq酶活性,使PCR扩增效率明显降低。

图 5 4号、5 号样本属于溶血样本,需要重新采血
(2)血脂过高,使血浆呈乳白色,低密度脂蛋白对荧光有屏蔽和吸收作用,故对Real Time PCR有干扰。

图 6 重度的图示为脂血+溶血现象
(3)血浆中胆红素含量过高,肉眼观看显黄色,胆红素可抑制Taq酶活性。
除严重溶血情况外,其他情况视DNA 提取结果确定是否可进入后续检测
4.实验废弃物处理
到保存期后,标本、容器以及检验过程中接触标本的材料应按《医疗废物管理条例》(国务院令第380号)、《医疗卫生机构医疗废物管理办法》(中华人民共和国卫生部令(第36号))、《全国临床检验操作规程》(中华人民共和国卫生部医政司,第四版)的相关规定处理。
第三章:cfDNA 提取、定量与储存
1. cfDNA提取
常用的 cfDNA 提取试剂盒包括以下几种:
(1)QIAamp Circulating Nucleic Acid Kit (Qiagen),具体操作步骤见产品说明书(货号:55114)。
(2)MagMAX Cell-Free DNA Isolation Kit(Thermo Fisher Scientific),具体操作步骤见产品说明书(货号:A29319)。
(3)Cobas® DNA Sample Preparation Kit(Roche, 适用Cobas® EGFR突变检测试剂盒)
2. cfDNA 定量(可选)
(1)提取 DNA 经过充分混匀之后(涡旋振荡)再进行定量
(2)常用的定量仪器方法包括以下两种:
1)Qubit® 3.0(Thermo Fisher),操作方便,结果良好,临床采用较多
2)荧光定量或定量 RT-PCR 法,相比于用分光光度计法定量,敏感性和准确性较高。定量 PCR 可选试剂盒包含ABI TaqMan® RNase P Detection Reagents Kit 和 TaqMan® Universal PCR Master Mix (Thermo Fisher Scientific, Waltham, MA, USA)。RNase P 检测复制子大小为 87bp时,适宜检测 cfDNA。
3. cfDNA 储存
cfDNA提取后应立即进行后续检测。若由于条件限制,不能立即进行后续检测而需要储存cfDNA, 首选-80℃冰箱冻存。若无-80℃冰箱,可选择-20℃保存。应尽可能缩短冻存时间,尽快进行后续检测。冻存时注意密封及标记完整,避免反复冻融。
第四章:EGFR/T790M 突变检测
EGFR/T790M血液样本突变检测主要通过扩增阻碍突变系统(ARMS)、数字PCR(digital PCR)系统以及NGS(Next generation sequencing)系统等三大平台进行。ARMS属于半定量检测方法,是目前临床应用最广泛的EGFR检测方法。用于T790M血浆检测的ARMS方法主要包含cobas® EGFR Mutation Test v2及厦门艾德生物医药科技股份有限公司开发的super-ARMS检测。Super-ARMS检测灵敏度可达0.2~0.5%,报告周期约为3~4天。数字PCR是目前颇受关注的一类新技术平台。国外临床转化研究显示其是一种高度灵敏能够绝对定量的血浆EGFR/T790M突变检测方法[6-11],其检测灵敏度可达0.1%以下,主要平台包含Bio-RAD公司生产的QX200 ddPCR、ThermoFisher公司生产的QuantStudio 3D PCR以及Sysmex Inostics公司生产的BEAMING PCR。国内基于数字PCR平台的相关EGFR/T790M临床检测试剂盒正在开发中。二代测序NGS平台是检测多基因多突变位点的高通量理想方法,除检测已知突变位点外,还可以检测未知突变位点。但其操作流程较为复杂,数据分析解读对人员要求较高,报告周期多在2~3周左右,相关临床应用质控及规范尚在完善当中。
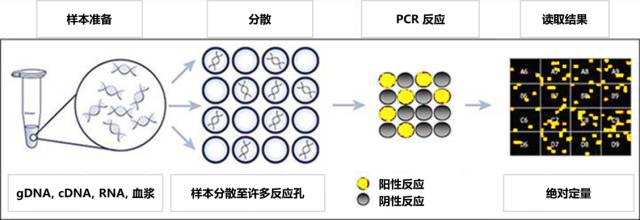
图 6 数字PCR 流程图。主要包括样本准备,分布,PCR反应和数据输出
第五章:检测报告
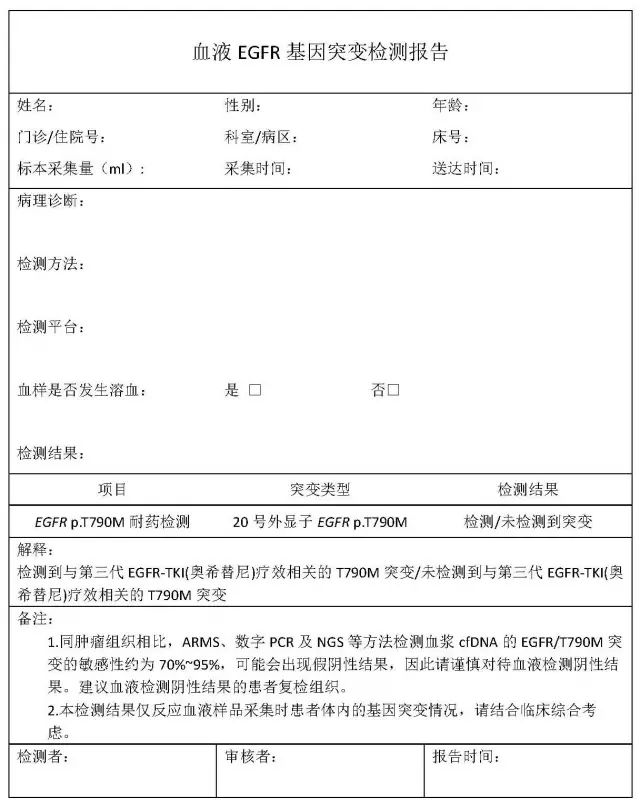
EGFR/T790M基因突变检测报告可参考非小细胞肺肿瘤血液EGFR基因突变检测中国专家共识中所要求的内容[12],应包含患者及标本基本信息、DNA质量、检测方法、检测仪器、检测结果(建议包括明确的病理诊断及专业书写)及结果解读诠释、相关临床意义及检测过程中出现的状况及不确定结果和因素,以供临床医师全面参考。从接收标本到出具报告的周期建议不超过3个工作日,以满足临床需求。检测报告模板参见附件一。
参考文献
1.Langer CJ. J Clin Oncol. 2013;20;31(27):3303-3306.
2.Yu HA, et al. Clin Cancer Res. 2013;19(8):2240-2247
3.S. Novello et al. Ann Oncol 2016;27:v1-v27
4.NCCN2017. V1
5.石远凯,等.中国原发性肺肿瘤诊疗规范.中国肺肿瘤杂志.2016;19(1):1-15.
6.Zhu G, et al. J Mol Diagn. 2015;17(3):265-272.
7.Karlovich C, et al,Clin Cancer Res. 2016;22(10):2386-2395.
8.Thress KS, et al. Lung Cancer. 2015;90(3):509-515.
9. http://cancerres.aacrjournals.org/content/75/15_Supplement/5248.short.
10.Heather A, et al. abs 9001 ASCO 2016.
11.Oxnard GR, J Clin Oncol. 2016;34(28):3375-3382
12.中国非小细胞肺肿瘤血液EGFR基因突变检测中国专家共识,中华医学杂志,2015:95(46),3721-3726
血液EGFR基因突变检测报告模板