- A+
"
近几年,大家都在频繁的谈及肿瘤NGS大panel及TMB,因为从检测成本,检测周期及组织样本可及性等方面来说,TMB的临床检测更倾向于使用肿瘤NGS大panel,而非WES或WGS。因此,肿瘤NGS大panel检测的标准化建立显得至关重要!
2016年,JCO报道的研究显示,肿瘤NGS大panel检测相较于单基因热点检测以及NGS小panel检测来说,更加全面,能够准确的将患者分层至最佳治疗路径。反观单基因热点检测和NGS小panel检测,则可能因漏检导致患者错失最佳的治疗方案。1
TMB作为近几年免疫治疗疗效敏感性评估的关键生物标志物,已成为临床基因检测的标配,但其检测评估必须使用NGS大panel(>300基因或>1.0Mb),小panel到大panel是精准医疗发展的必然趋势。2
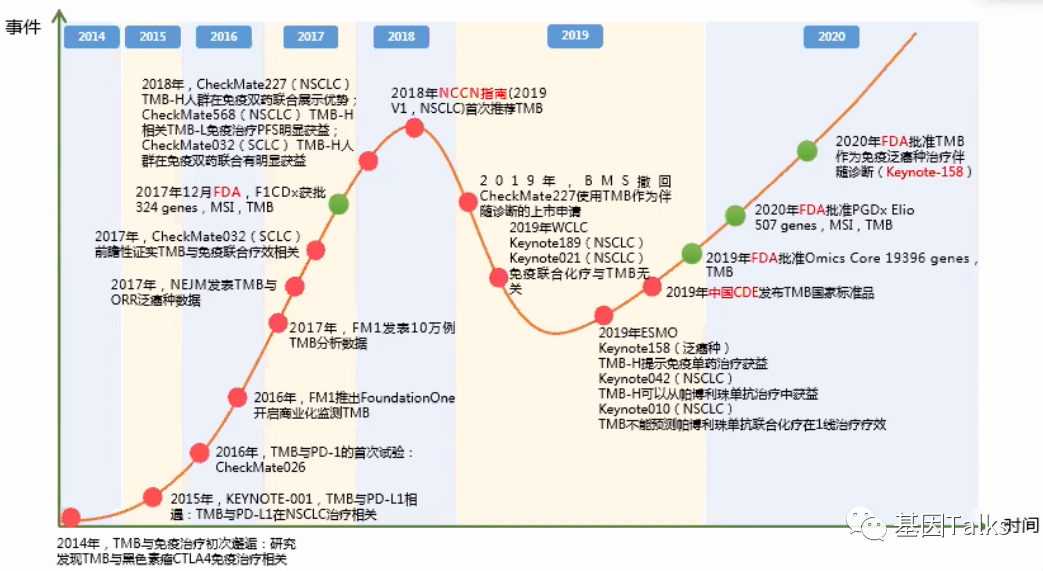
▲ TMB的发展历程
2017年,FDA相继于11月认证(FDA-cleared(510K),二类)和12月批准(FDA-approved,三类)了MSK-IMPACT(468基因)和F1CDx(324基因)两款NGS大panel产品;2019年11月,FDA认证 Omics Core NGS大panel产品(19,396基因);2020年4月,FDA认证PGDx Elio Tissue Complete NGS大panel产品(507基因);2020年8月,FDA批准了F1LCDx首个液体活检NGS大panel产品(324基因,报告311基因);以上所有FDA认证/批准的NGS大panel产品均可检测TMB或bTMB,并且F1CDx已于2020年6月正式获FDA批准成为免疫治疗药物K药的泛实体瘤伴随诊断。
在美国,基于肿瘤组织或血液的NGS大panel检测标准已非常成熟。此外,美国通过FoCR的TMB评估计划(商业细胞系)建立了为临床研究输出TMB评估推荐的标准规范。
在中国,目前还没有基于肿瘤组织或血液的NGS大panel产品获批,虽有多家肿瘤基因检测公司正在积极注册申报NGS大panel,但仍缺乏相应的标准化,尤其是TMB的检测评估标准化。
中国肿瘤NGS大panel检测的标准化亟待解决,下面跟大家分享中检院 曲守方 研究员带来的“肿瘤大panel检测的标准化及研究进展”。(PPT内容来源于CSCO 2020线上卫星会,供大家参考)3



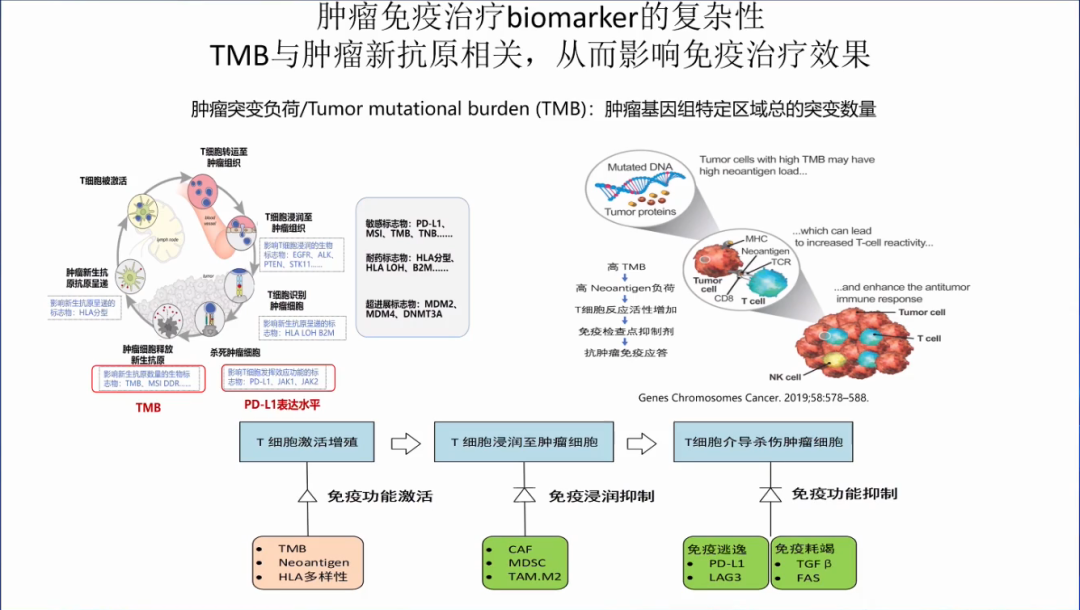
肿瘤免疫治疗相关生物标志物是非常复杂的,有敏感的标志物:PD-L1高表达,MSI-H,TMB-H,TNB-H等;有耐药的标志物:HLA等位基因杂合性缺失,B2M突变等;有超进展的标志物:MDM2扩增,MDM4扩增,DNMT3A突变等。
TMB与新抗原呈正相关,其与肿瘤微环境和周围的抗癌T细胞增加密切相关,因此可作为免疫检查点抑制剂生物标志物。
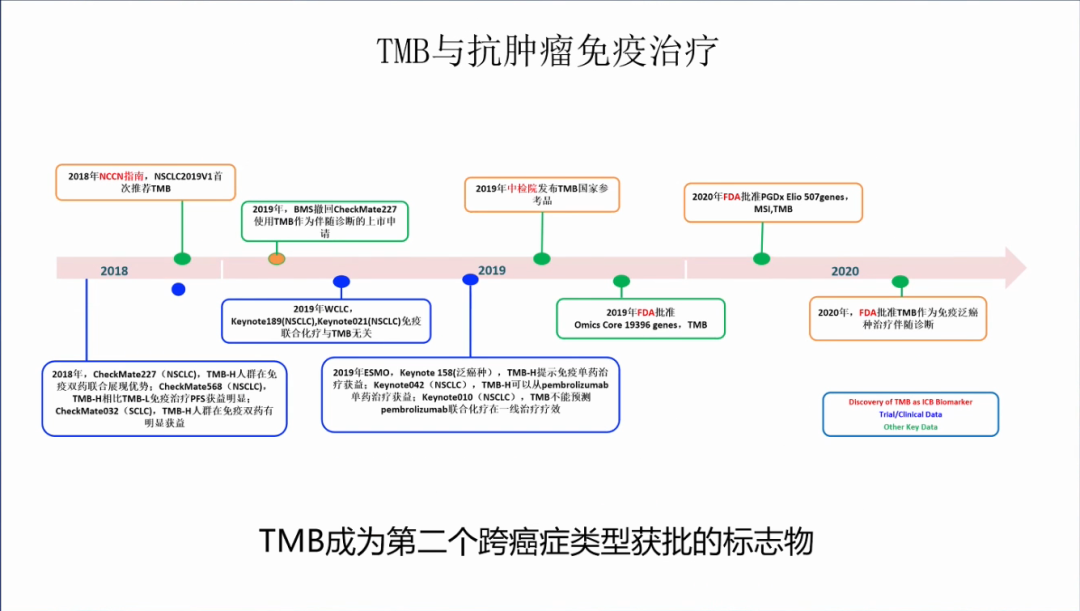
TMB的曲折之路:2018年TMB写入肺癌NCCN指南;2019年WCLC和ESMO相继报道 KN189,KN021,KN010 研究,认为免疫联合化疗与TMB无关,同时,ESMO也报道了 KN158和KN042研究,认为免疫单药获益与TMB相关。在TMB备受争议之时,中检院发布了TMB国家参考品,承受了不小的压力。
2020年,FDA批准了TMB作为泛实体瘤免疫单药(K药)治疗的伴随诊断。
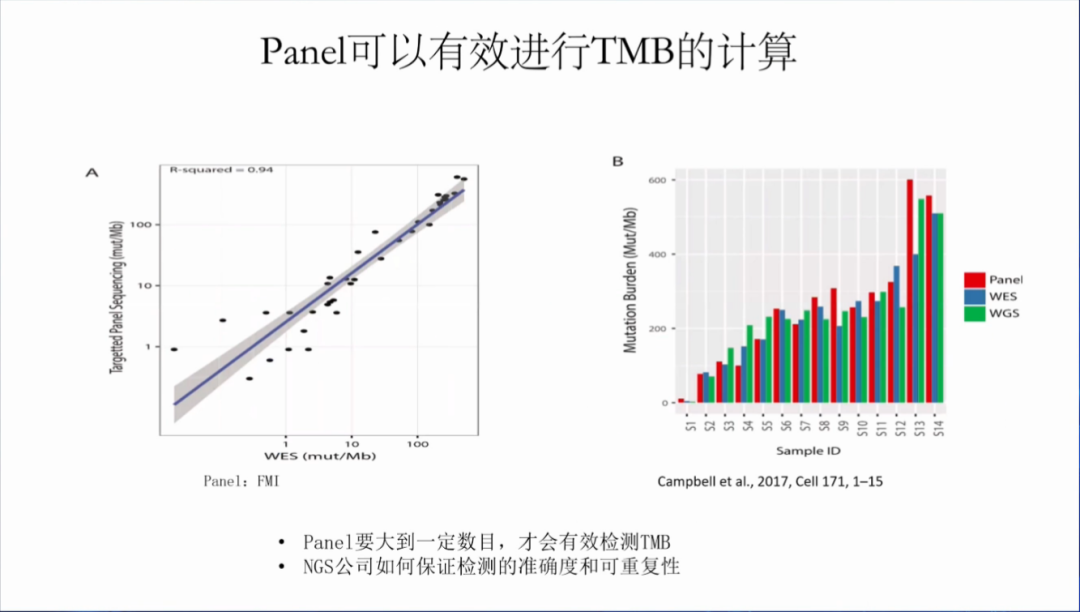
TMB的检测金标准是WES,但临床检测更倾向于使用NGS大panel(目标基因大panel),所以各个厂家分别开发了自己的NGS大panel产品,然后与WES做个拟合分析,就推出了TMB检测产品。
虽然NGS大panel可以有效进行TMB的计算,但是panel需要大到一定的数目,才可有效检测TMB。此外,TMB的检测应保证检测的准确度和可重复性。
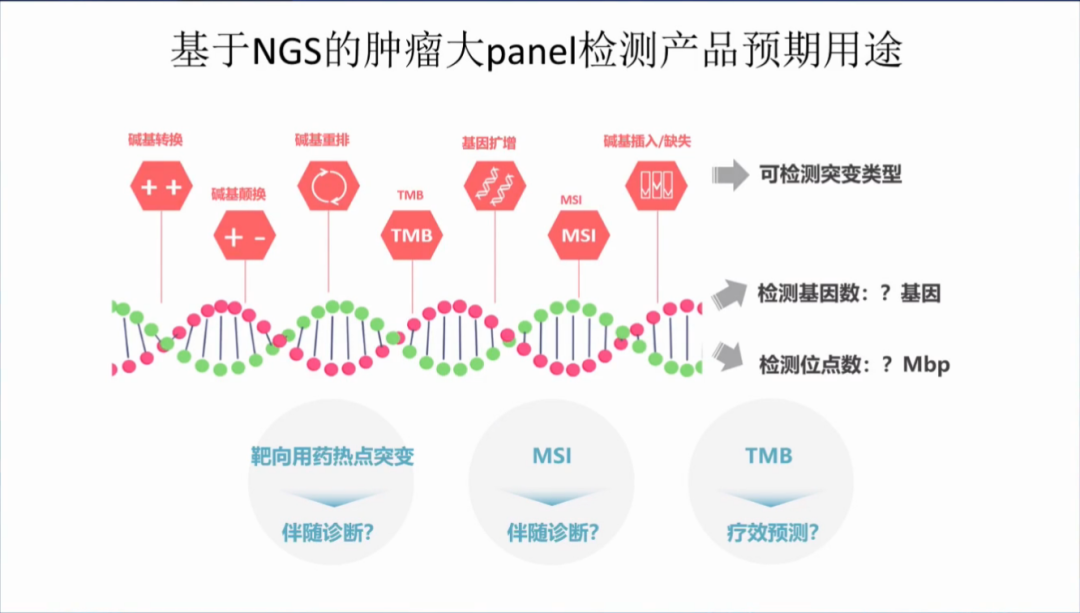
开发肿瘤NGS大panel检测产品,除了可检测TMB以外,还有哪些预期用途呢?可作为靶向用药热点突变的伴随诊断,也可作为免疫MSI的伴随诊断,此外,也包含免疫耐药和超进展相关的基因。

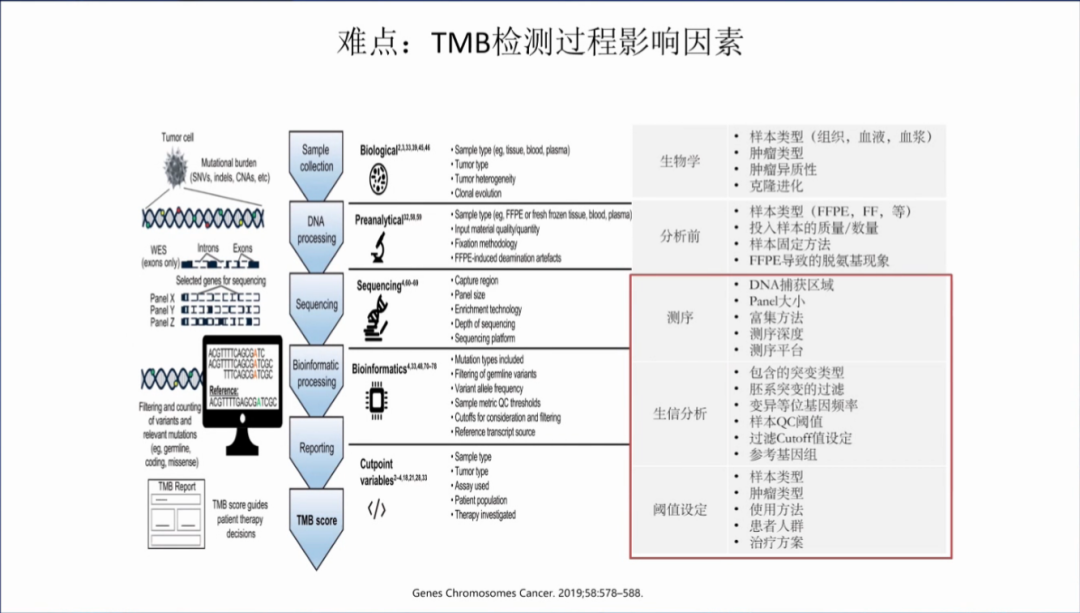
TMB检测过程中的影响因素,包括生物学特性(样本类型,肿瘤类型等),分析前因素(样本类型,样本质量/数量等),测序因素(DNA捕获区域,panel大小,富集方法,测序深度,测序平台),生信分析(突变类型,胚系过来吧,过滤cut-off值等)及阈值设定(样本/肿瘤类型,使用方法,患者人群,治疗方案)。
中检院和实验室主要关注于后面三个部分,即测序,生信分析和阈值设定;对于生物学和分析前因素,希望能够在临床上得以解决。

目前,欧美已经建立了TMB基因检测产品的标准化评估体系,如美国的FoCR(Friends of Cancer Research)项目和欧洲的QuiP(Quality Assurance Initiative forPathology)项目。
在标准品开发方面,FoCR使用商业细胞系;QuiP使用临床样本,使用WES和panels分别评估TMB;使用11个TMB平台和试验,使用不同的TMB评估参数,同步评估已发表文章中的TMB cut-off值;为临床研究输出TMB评估推荐规范。
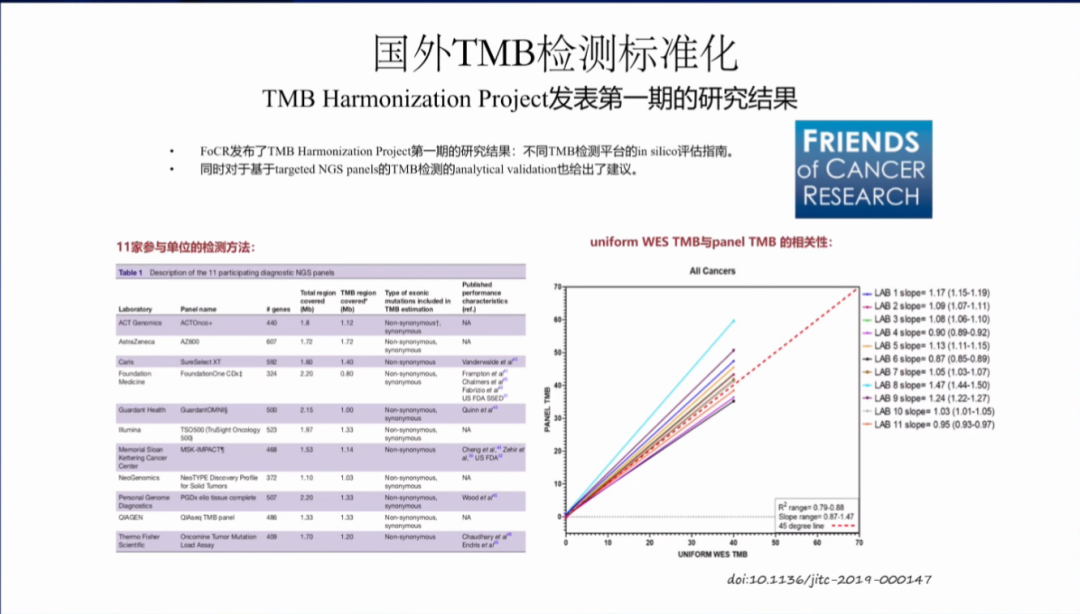
FoCR已经发布了TMB的第一期研究成果,包括不同TMB检测平台的一些评估指南,发现基于目标区域捕获的NGS大panel与WES具有一定的相关性,同时对于NGS大panel TMB检测的分析验证也给出了建议。
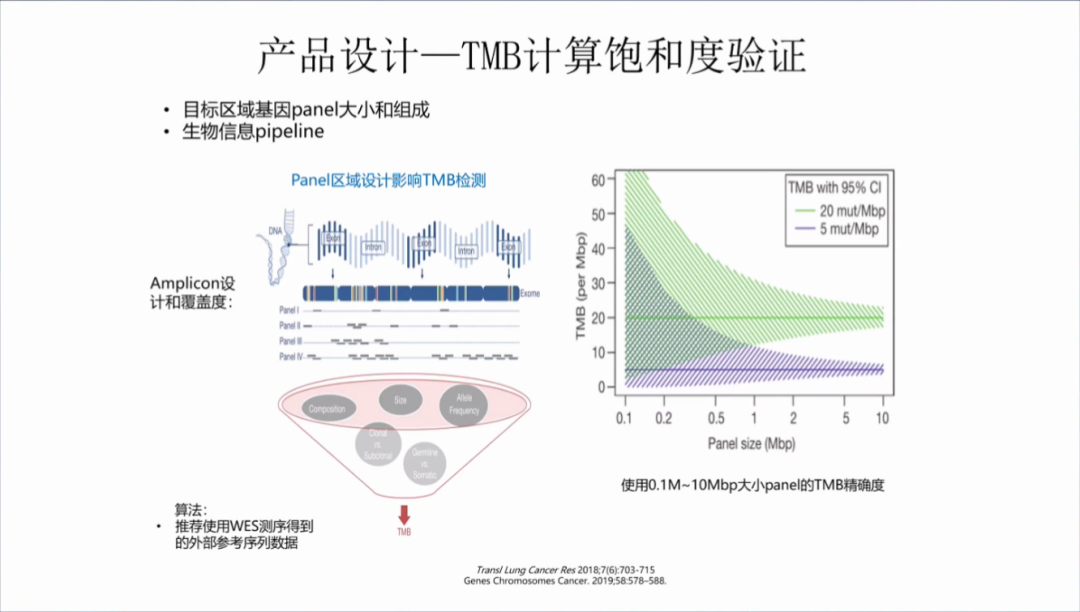
NGS大panel产品设计:重点关注TMB计算饱和度验证,目标区域基因panel需达到一定的大小(panel区域设计影响TMB检测),TMB的检测评估才能具有一定的精确度;其次是,生物信息的流程的搭建。
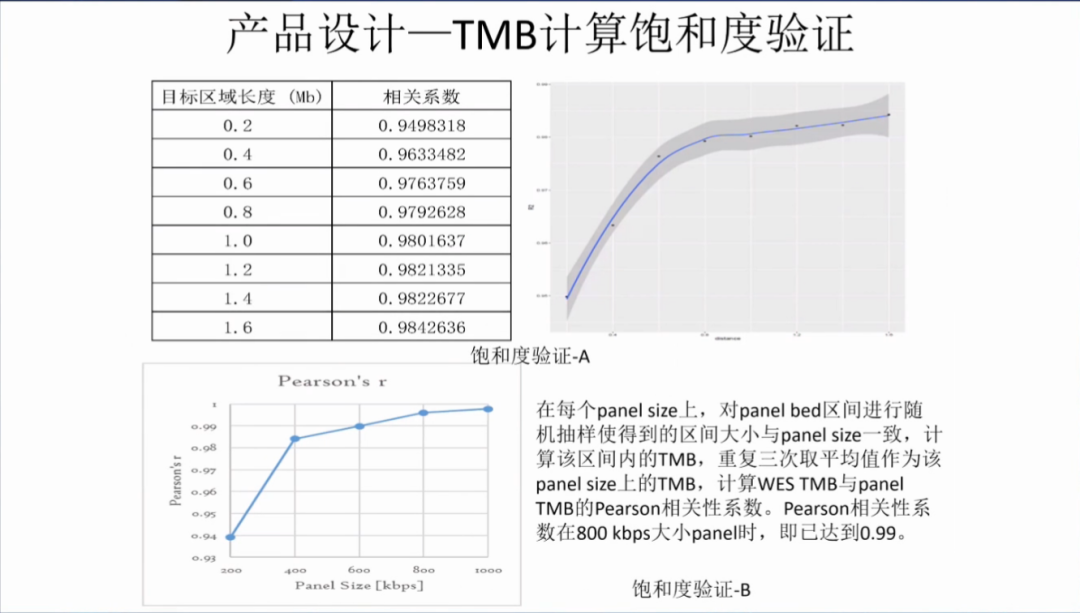
在TMB计算饱和度验证方面,中检院开展了两个方面的研究:在A研究中,发现目标区域长度在1.0Mb时候,可以达到饱和,相关系数达到0.98;在B研究中,对panel bed区间进行随机抽样,重复三次取平均值计算TMB,并计算WES与大panel的pearson相关系数,发现在0.8Mb时,pearson相关系数已经达到0.99。

目前,WES和NGS大panel检测产品在TMB计算规则方面尚无定论。希望厂家在开发NGS大panel的时候考虑到TMB的计算规则是如何拟定的。
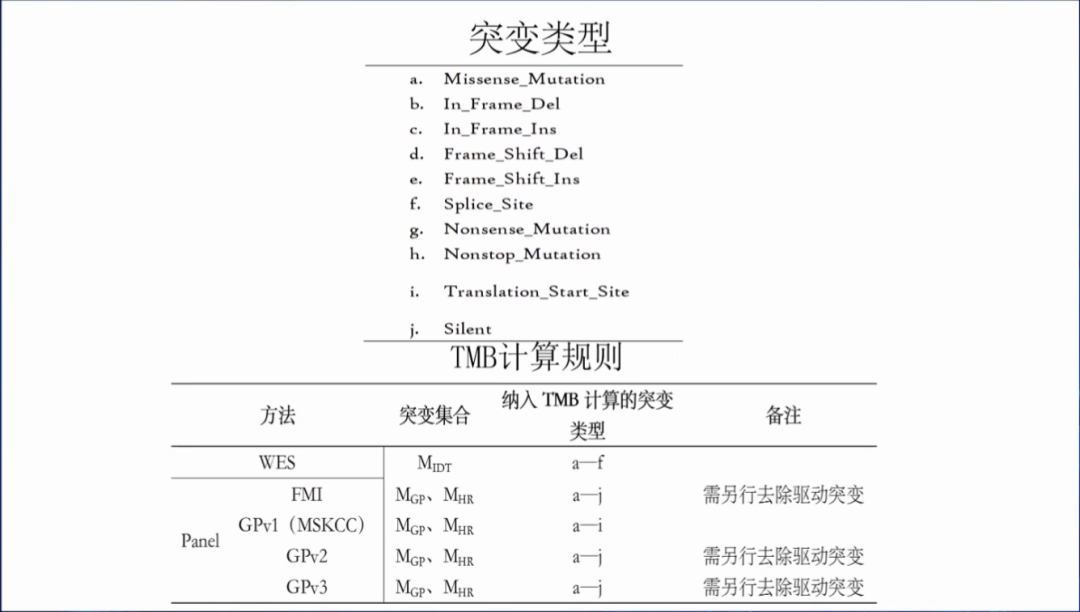
并需另外去除驱动突变。
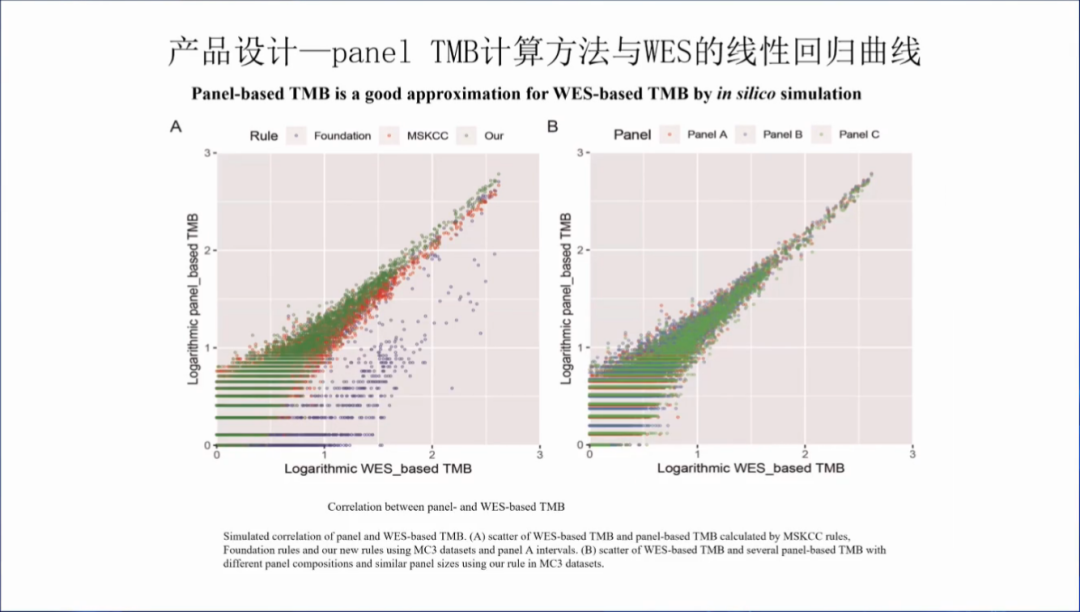
中检院做的NGS大panel TMB计算方法与WES的线性回归曲线,可以发现两者的一致性比较好。
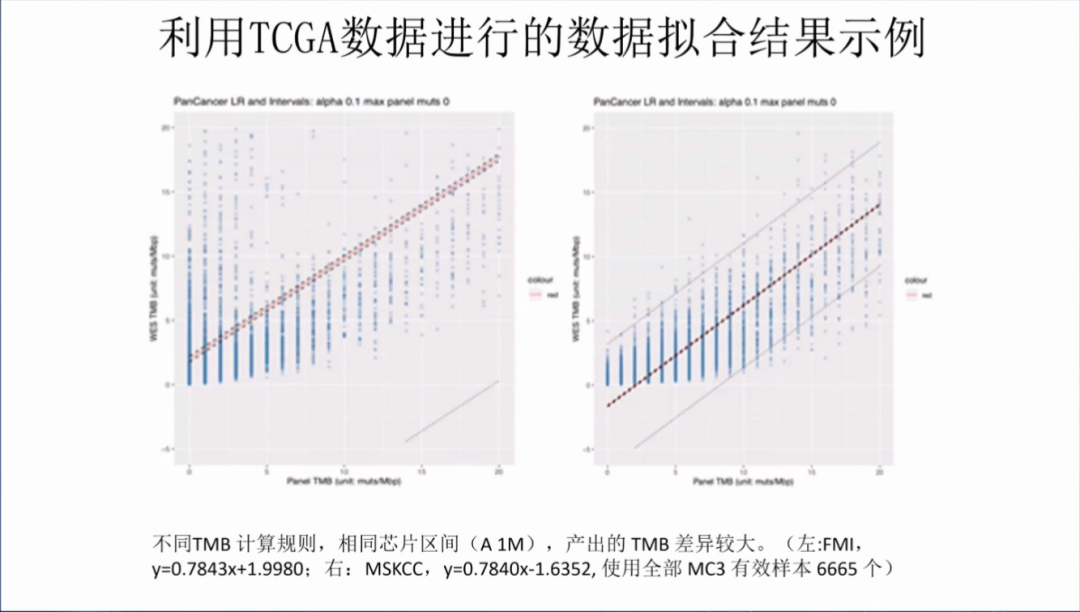
中检院利用TCGA数据进行的TMB数据拟合,可以发现,不同TMB计算规则,相同芯片区间,产出的TMB差异较大。
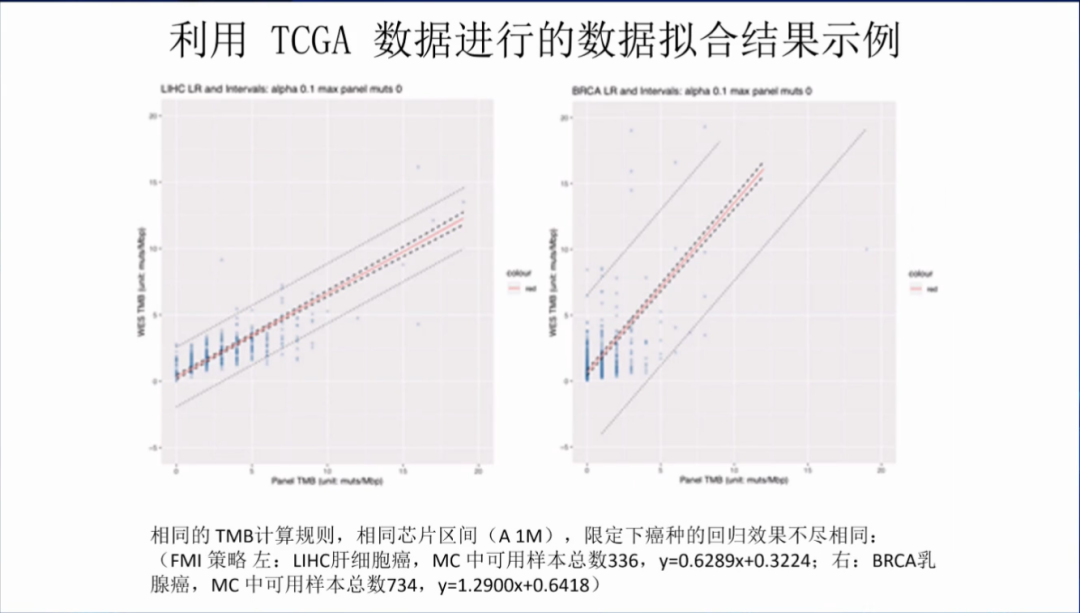
此外,中检院使用相同的TMB计算规则,发现在相同的芯片区间,限定下癌种的回归效果也不尽相同。

对于TMB检测性能评价,主要考虑以下几个方面:
1,突变位点检测准确性评价;
2,TMB检测一致性评价;
3,和WES一致性评价;
4,和具有临床药效样本检测一致性评价。
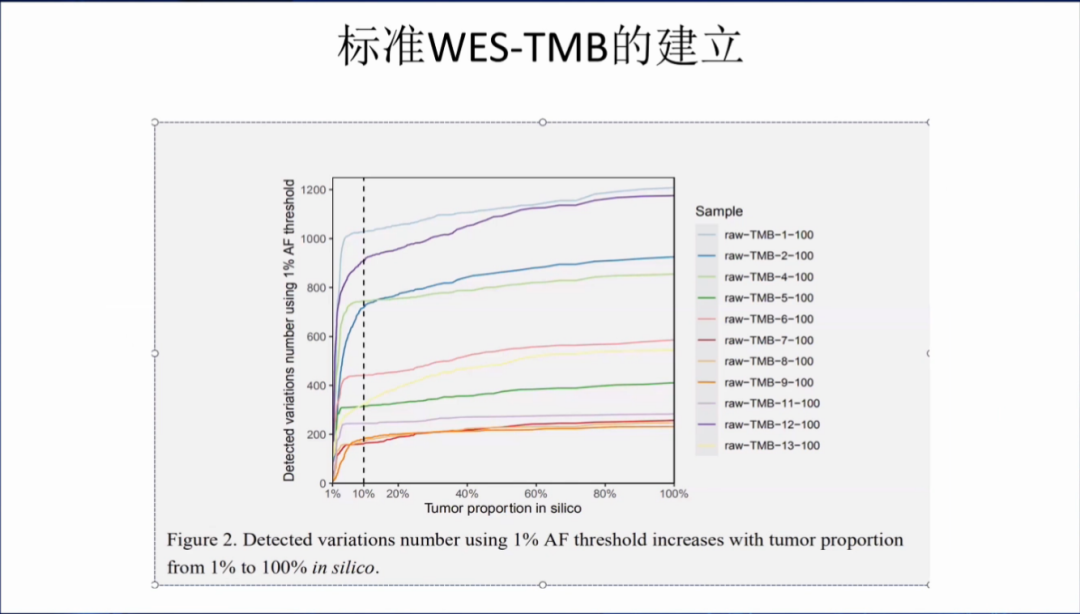
考虑突变频率AF的情况,1% AF的情况下,肿瘤细胞的含量越高,TMB的准确性越高。
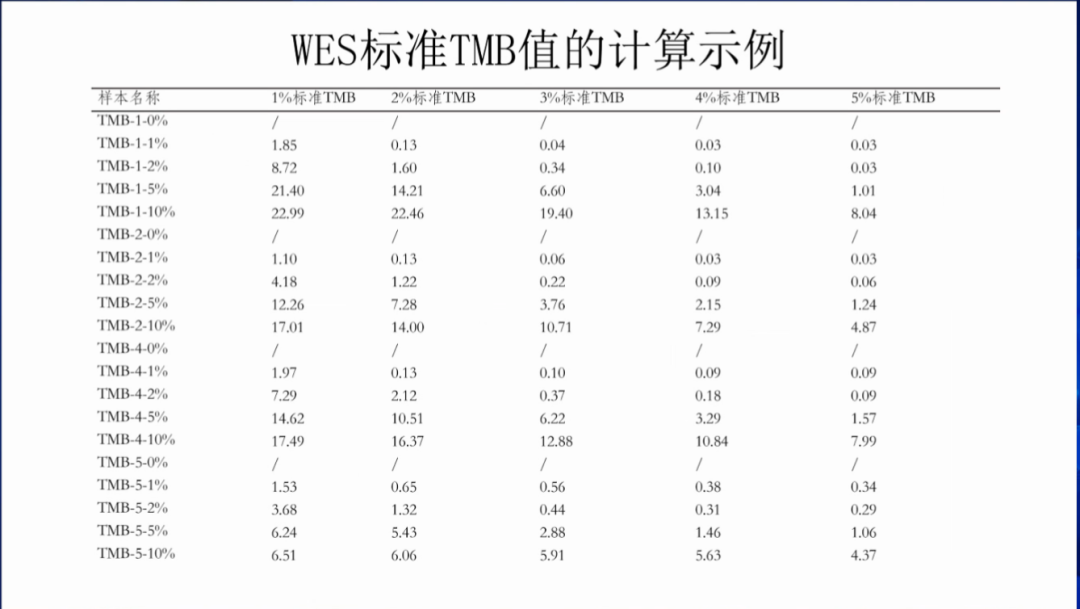
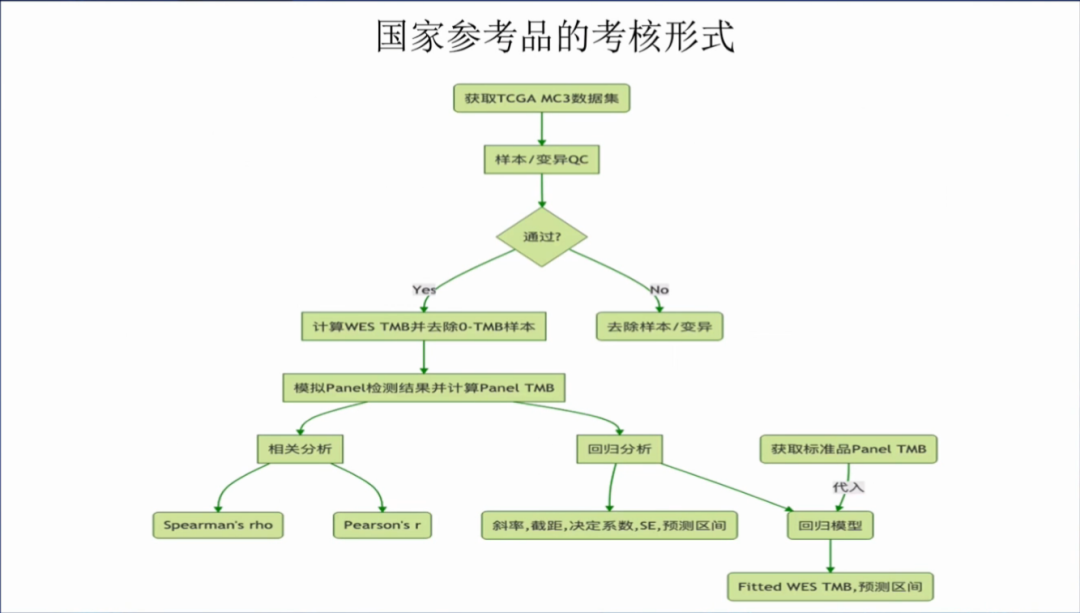
国家参考品的考核形式:获取TCGA MC3数据集,计算WES TMB并去除0-TMB样本,最后是6,701个样本,然后模拟panel检测结果并计算panel TMB值,相关分析包括P和S系数;然后建立回归分析方程,再将获取的标准品panel TMB值代入回归方程,计算WES TMB的预测区间(90%),如果你的WES TMB值落入在预测区间中,那么你的TMB检测是准确的。
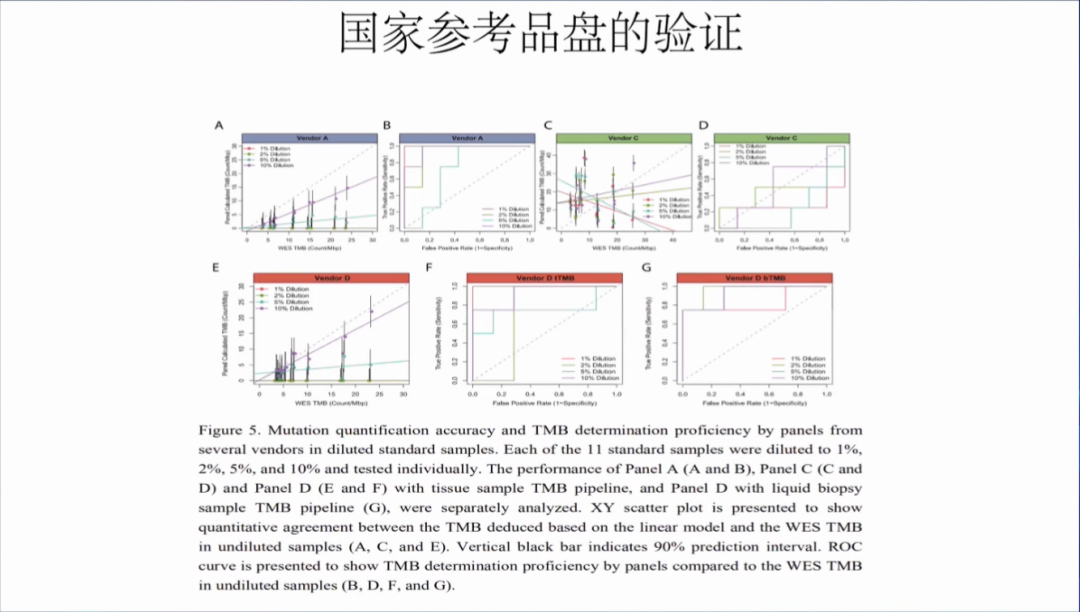
国家参考品盘的验证结果,对panel A(A+B),C,D的TMB计算进行了分析,分析的肿瘤细胞含量包含了1%,2%,5%和10%,发现TMB的值均落入90%的预测区间内,同时进行了ROC分析,发现准确性和特异性均较好。
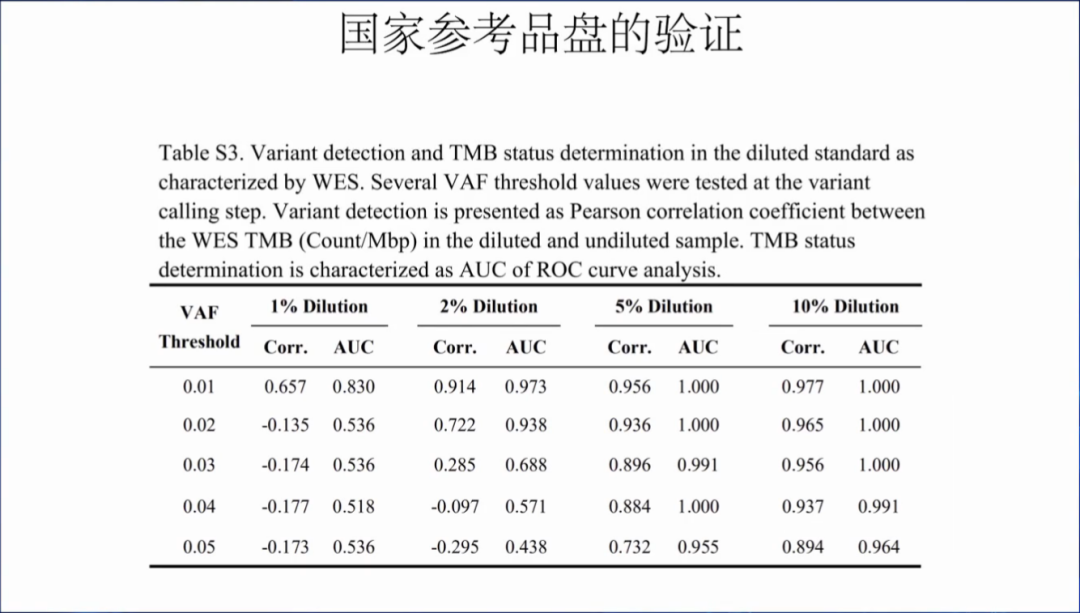
国家参考品盘的验证结果,AF为1%,2%,3%,4%和5%,肿瘤细胞含量为1%,2%,5%和10%,主要提醒大家在开发的时候需要注意自己检测产品的AF阈值。

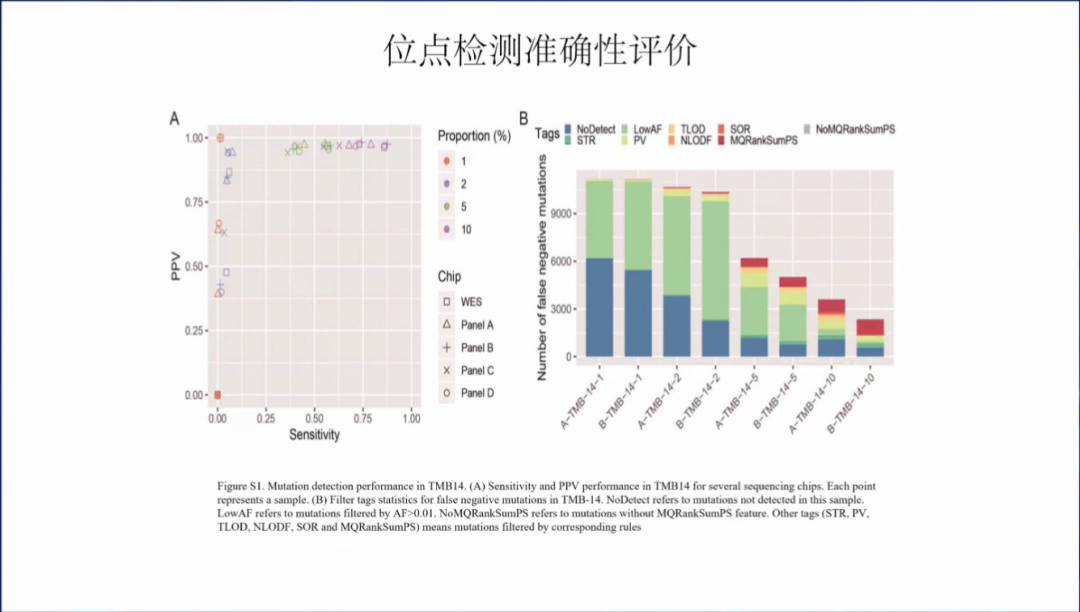
位点检测准确性评价:设置了TMB-14号样本,参考测序仪性能评价参考品的标准的高置信SNP/indel位点的建立方法进行了TMB-14样本中两种细胞系的全基因组测序。然后构建了一个高置信参考变异集。
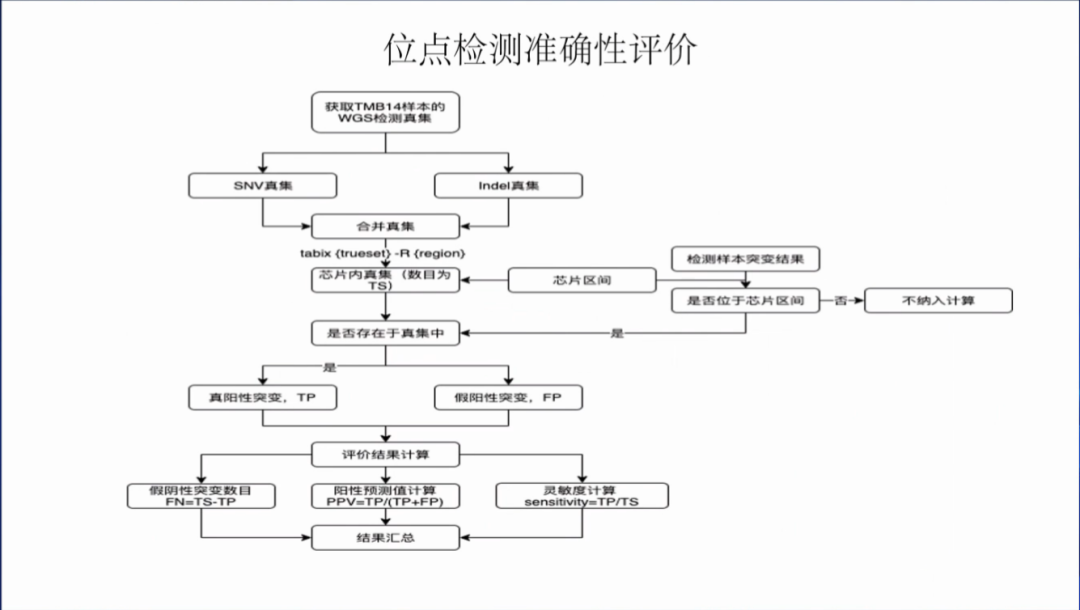
位点检测准确性评价过程。
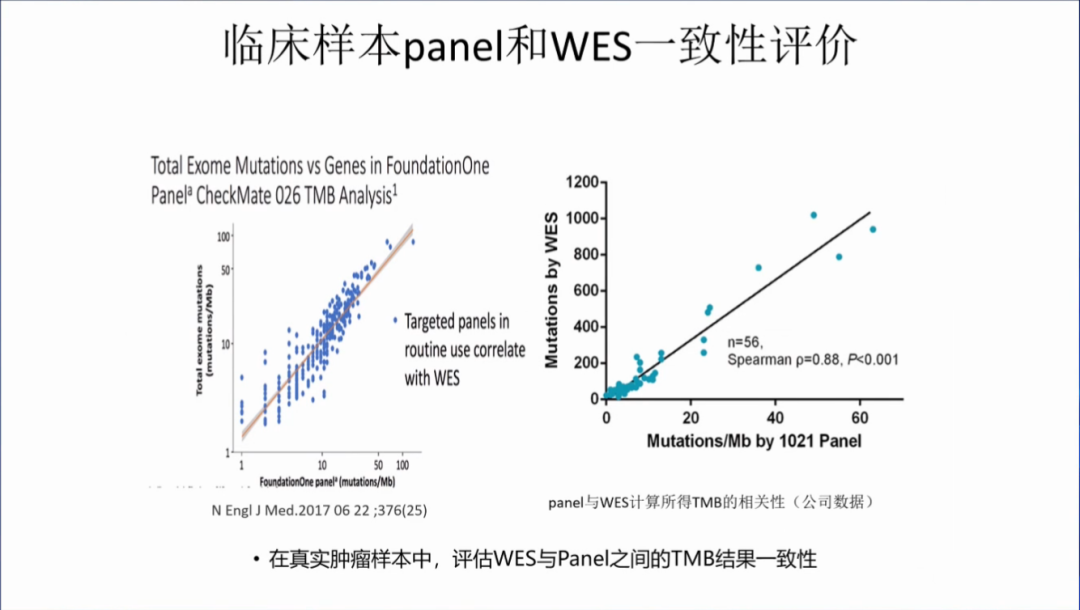
同时,需要考虑临床样本panel和WES一致性评价,在真实肿瘤样本中,根据不同的建模方式,将panel TMB值代入回归方程中,看是否落在90%的预测区间中,来证明临床样本panel和WES的一致性。建议多准备点样本,中检院要求准确性>90%,所以至少要准备15份样本。
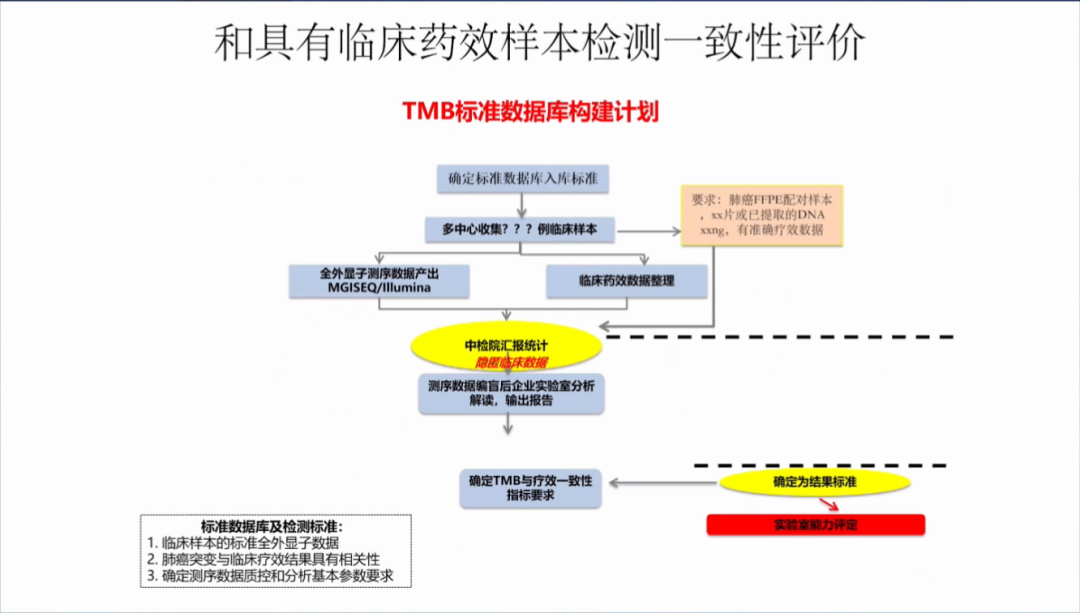
需要考虑和具有临床药效样本检测一致性评价,进行TMB标准数据库构建计划。
1,临床样本的标准WES数据;
2,肺癌突变与临床疗效结果具有相关性;
3,确定测序数据质控和分析基本参数要求。

TMB计算规则建立及验证全程中的质量控制标准化:
1,下机数据质控;
2,panel饱和度,计算规则验证;
3,参考品检测;
4,TMB数据一致性;
5,监管数据库复核。


TMB检测标准化困境或挑战:产品设计方面,TMB的cut-off值,设立及验证?产品预期用途是单药?联合用药?疗效预测?
标准化方面也有很多困境:不用肿瘤的阈值的标准化;不同算法的标准化;性能指标验证方法的可操作性。
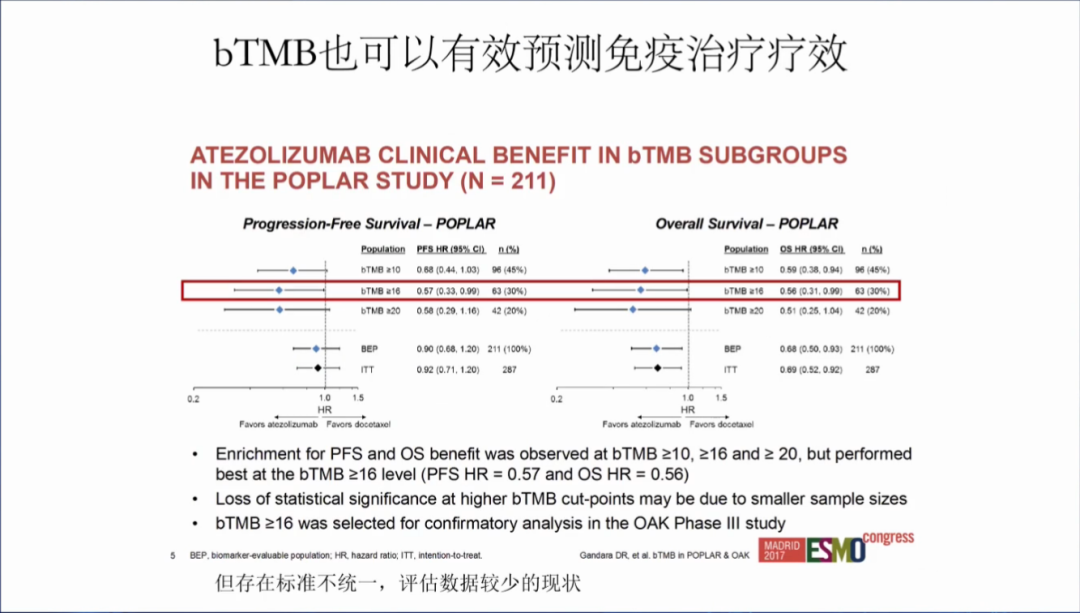
bTMB也可以评估免疫治疗的效果,但存在标准不统一,评估数据较少的情况,也是未来的应用趋势。

目前,中国还没有基于肿瘤组织或血液的NGS大panel产品获批,不过相信随着NGS大panel检测的标准化发展和建立,将会有更多的基因检测公司参与到NGS大panel检测产品的注册申报中,亦有利于促进中国肿瘤精准诊疗行业的进一步发展。
参考资料:
1.Lyle, Stephen, et al. “Comparison of a Large NGS Panel to Hot-Spot Testing and Small Panels for the Ability to Accurately Stratify Advanced Colorectal Cancer Patients to Appropriate Treatment Pathways.” Journal of Clinical Oncology, vol. 34, 2016, pp. 510–510.
2.Büttner Reinhard,Longshore John W,López-Ríos Fernando et al. Implementing TMB measurement in clinical practice: considerations on assay requirements.[J] .ESMO Open, 2019, 4: e000442.
3.曲守方.,同源重组修复缺陷(HRD)检测产品开发与申报中的思考,PPT,CSCO裕策博卫星会,20200924.
本篇文章来源于微信公众号: 基因Talks