- A+
近些年来,以PD-1/PD-L1为代表的免疫肿瘤药物获批各大癌种,并且取得了不俗的成绩,在给患者带来希望的同时,我们也不得不面对一项残酷的事实:PD-1抗体对大部分肿瘤的有效率仅有20%-30%,这意味着至少70%的人无法从PD-1治疗中获益,且PD-1耐药的后续用药问题也十分让人头疼。
幸运的是,自2018年被称为第二代PD-1抗体的M7824横空出世以来,癌度持续在第一时间报道了这款升级版PD-1抗体的创新数据,见证了一个又一个欣喜:
往期报道:

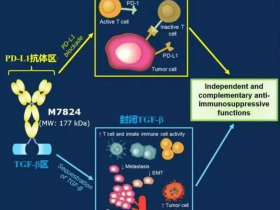
M7824被称为升级版PD-1的原因在于该药将TGF-β的蛋白受体与抗PD-L1单抗融合到一起,一方面可以识别结合PD-L1 的抗体结构,另一方面识别结合TGF-β的受体,双管齐下,从两个不同通路上阻断了肿瘤细胞逃脱免疫监管,让肿瘤细胞无计可施,从而大幅增加治疗有效率,由此也被称为“二代”PD-1或“升级版”PD-1。
近日,一篇发布在胸部肿瘤学(JTO)杂志的文章公布了非小细胞肺癌(NSCLC)患者后线使用M7824的最新临床试验结果显示,该药的总体客观缓解率(ORR)为37%,PD-L1表达≥80%人群ORR高达85.7%!
该研究是一项I期临床研究,纳入了80例既往接受铂类化疗后疾病进展且未接受过免疫治疗的晚期NSCLC患者,按照1:1随机分组,每两周接受一次500 mg或1200 mg的M7824治疗,该研究的主要研究终点为最佳总体缓解(BOR),主要通过客观反应率(ORR)进行评估。
作为一项全球研究,大家肯定想了解该项研究是否纳入了亚裔患者,入组患者PD-L1表达如何,之前接受的治疗情况等信息,从而明确M7824的效果。此次入组人群中,半数为亚裔患者,针对PD-L1表达进行检测,72.5%(53例)为PD-L1阳性,16.3%(13例)为PD-L1高表达(≥80%),有78.8的患者既往接受了一线治疗,其余患者均接受过二线及以上治疗方案。
试验数据令人欣喜!在51.9周的中位随访时间里,所有患者的总体ORR达到21.3%,疾病控制率(DCR)为40%,中位缓解持续时间(DOR)为14.1个月。该项研究分为500 mg和1200 mg两个剂量组,我们分别来看,两组的ORR分别为17.5%和25%,DCR分别为32.5%及47.5%,500 mg的中位DOR为14.1个月,而1200 mg组并未到达,由此可见1200 mg的剂量对患者效果更佳,因此也被定为II期研究的推荐剂量。
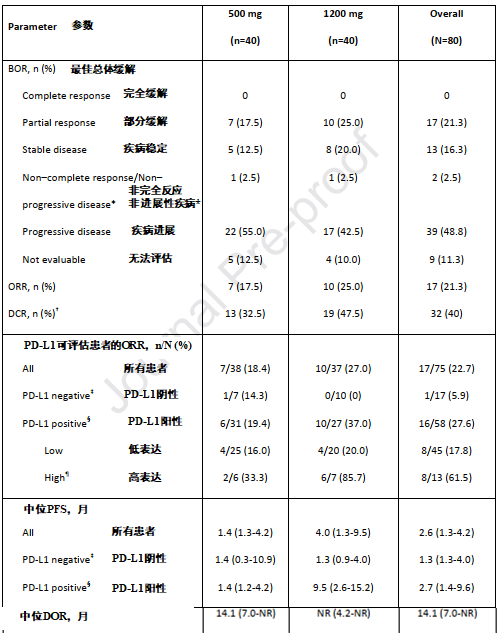
既然是PD-1类药物,当然要根据PD-1表达进行分层分析,我们看到在PD-L1阳性患者中,总体ORR为22.7%,其中1200 mg组达到27%,PD-L1高表达患者中,ORR可达61.5%,其中1200 mg组ORR飙升至85.7%。
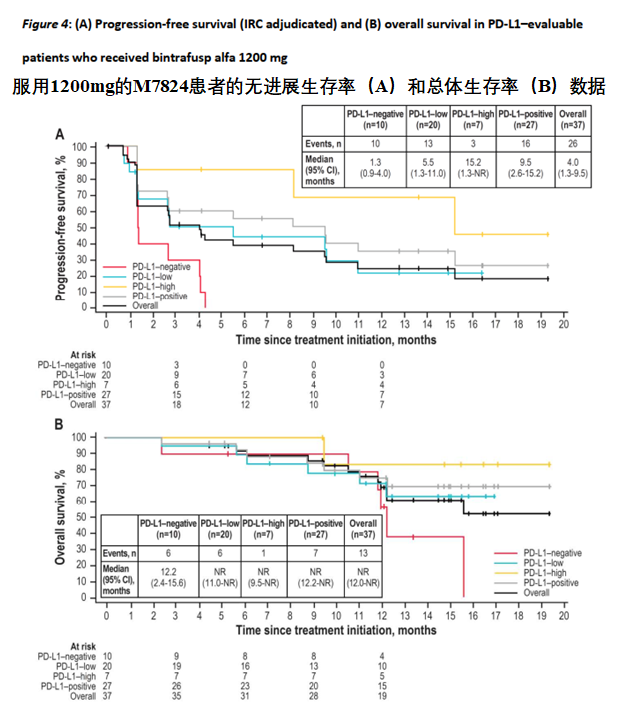
所有患者的中位无进展生存期(PFS)为1.6个月,12个月的PFS率为20.1%。500mg及1200mg组的中位PFS分别为1.4个月和2.7个月。并且随着PDL1表达升高,PFS也逐渐延长。在1200mg组中,PDL1表达阳性和高表达患者的PFS分别达到9.5和15.2个月,12个月的PFS率也提升为35.4%和68.6%。
总生存期(OS)方面趋势亦是如此,若有患者的OS为13.6个月,500mg及1200mg组的中位OS分别为10.9个月和15.6个月,12个月的生存率为44.6%和65.5%。在1200 mg组中,PDL1表达阳性和高表达患者的OS均为达到。
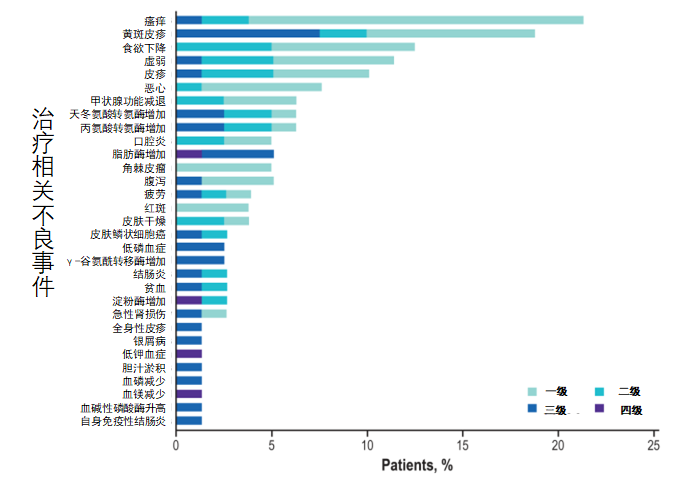
安全性方面,此次研究的治疗相关不良反应(TRAE)发生率为69%,但多数较为轻微,3级及以上TRAE仅为29%,有8例患者因TRAE导致停药,未发生治疗相关的死亡事件,由此看来,M7824抗体的安全性与PD-1单抗无显著性差别,并未因为增加一个作用靶点TGF-β受体而大幅不良反应率。
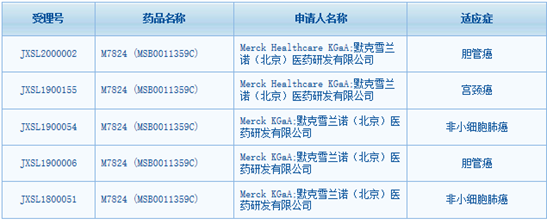
M7824 针对于多癌种的临床研究在国外早已开展,根据已公布临床数据,其针对晚期非小细胞肺癌、人 HPV 病毒相关癌症、胆道癌等多项肿瘤均显示出良好的临床结果,其已获得FDA授予的针对胆管癌的孤儿药资格。
在国内,M7824 针对于非小细胞肺癌、胆管癌、宫颈癌在内的多癌种的临床研究也在如火如荼的申报和开展,期待这款创新药物能将肿瘤治疗推向新的巅峰,造福广大病友!
本篇文章来源于微信公众号: 癌度