- A+

NSCLC
总体而言,非小细胞肺癌较正常组织有更高的免疫细胞浸润。对免疫细胞组成的直接分析或通过包括PD-L1表达水平,IFNγ相关通路分析以及多转录组学分析都能够直接或间接验证这种免疫浸润程度与适应性免疫反应的相关性。
尽管存在不同平台和不同抗体带来的变异,PD-L1≥1%大体可在60%NSCLC中观察到,而高表达(≥50%肿瘤细胞表达)则占25%-30%。对特殊T细胞进行分析,可在NSCLC肿瘤组织中发现显著高于正常组织的CD3+TILs,CD8+杀伤性T细胞,CD8+/CD45R0+效应记忆细胞,这种效应细胞的浸润被证实与更好的对免疫检查点抑制剂CPI的应答正相关。
高水平的CD4+辅助性T细胞存在,CD4+/FOXP3 Treg 和表达PD-1,LAG-3,TIM-3等免疫检查点的CD8+T细胞也在NSCLC肿瘤组织中存在并且参与免疫调控。
值得注意的是,B细胞通常在肿瘤组织的周围形成的第三级淋巴结构(TLSs)中驻扎,而后者在多项研究中被证实发挥着重要的免疫调节和刺激“炎症”的作用,与T细胞亚型组成,和TCR的克隆性同为正向的预后因素。肿瘤相关性巨噬细胞(TAM)和髓样细胞以及其他参与固有免疫的细胞亚群对于NSCLC预后/预测价值仍待进一步探索。
肺鳞癌与腺癌具有不同的免疫景观,后者有更高的驱动基因改变。
基于TCGA的RNA测序数据提示NSCLC相对于其他肿瘤有更高的CD8和PD-L1转录表达,提示其具有“T细胞inflamed”的特征。
SCLC
由于小细胞肺癌极少接受手术治疗,多为小活检组织,因此确认对其免疫特征的系统分析。在一些回顾性的队列数据中,IHC检测的PD-L1表达大约可见于0-71.6%的样本中,且在免疫细胞或间质细胞上表达,在前瞻性队列中,也可见到这样的表达率变异。曾有报道在肿瘤细胞上有17%的表达,另外的研究提示在肿瘤细胞 和/或间质细胞上有31.7%的表达。而高表达(超过50%细胞表达阳性)的情况在SCLC较罕见。
在定量分析中,13%的SCLC样本中可见CD8+TiLs 和72.1%FOXP3+Tregs,IHC定量分析了94例SCLC 提示中位CD8+细胞数为 264.6 个/mm2 , 远小于已知的肺腺癌(1040.8)和肺鳞癌(1365.6)。同样,通过多重免疫荧光检测发现,SCLC样本的CD8+细胞为肺腺癌的1/5.4, 为肺鳞癌的 1/6. TILs 与sclc OS之间缺少一致的关联性,进一步提示此类疾病中仅存在有限的免疫反应。高表达的CD14和CD68 局势细胞与患者的长期生存(超过2年)有关,提示髓样细胞参与SCLC的免疫编辑。在SCLC肿瘤中瞎跳的HLA抗原表达可能也是限制免疫反应的负向因素。
MPM 恶性胸膜间皮瘤
恶性胸膜间皮瘤被认为具有高度侵袭性。并且具有多种组织学特征和免疫表型。1/100肿瘤细胞阳性表达作为参考标准,在14%到72.4%。恶性胸膜间皮瘤样本中检测到PD-L1表达,并且与非上皮样组织学类型和和增多的肿瘤浸润t细胞正相关。
流式细胞学分析提示。在恶性胸膜间皮瘤的样本中,可见较高比例CD3+T细胞和CD33+单核细胞。和相对较低比例的CD19+B细胞,CD56+NK细胞,CD66b+中性粒粒细胞和CD123+DCs。在有PD-L1表达的案例中可见更高比例的Tregs 和表达抑制性免疫检查点的效应T细胞。
根据特定的免疫基因。表达分析提示。恶性胸膜间皮瘤可以被分为三种分子亚型。亚型1中(约占40%)提而其他60%的两个亚型中,则可观察到较高水平的PD-L1表达和B/T细胞反应相关的基因转录提示免疫检查点抑制剂在此类亚型中的治疗可能性。
KEAP1突变在肺腺癌(约17%,与STK11/LKB1突变同时发生,约11%)和鳞状细胞癌(约10-12%)中都很常见,并且与这两种肿瘤类型中高肿瘤突变符合(TMB)中的t细胞炎症特征负相关。PIK3CA与肺腺癌和肺鳞癌中降低的PD-L1表达相关。 TP53是基因组完整性的守护者,其突变失活与较高的TMB和炎性肿瘤免疫微环境相关,在KRAS突变的肺腺癌60和非鳞状非小细胞肺癌(无论KRAS状态如何)中,肿瘤细胞PD-L1表达增加。
参与DNA修复通路的其他突变,除外TP53突变,还包括 错配修复基因,POLE,和BRCA2也与增加的CD8+T细胞浸润相关,但是它们在NSCLC中的意义尚未被系统研究。
对于携带有明确驱动基因的亚型,EGFR+/ALK+与更高的PD-L1表达相关,但TMB和抗原负荷较低,并且伴有T细胞浸润减少等免疫抑制特征,这可能与降低的抗原性相关(antigenicity),这显著的降低了这部分患者从免疫检查点抑制剂治疗中获益的可能性。RET重排和ERBB2 mutNSCLC的PD-L1表达均较低。虽然MET exon14 和ROS1融合的NSCLC 具有较高的PD-L1表达,但迄今为止的临床证据并没有能够证明此类肿瘤,可以从检查点抑制剂治疗中获益。与此相反,携带有BRAF突变的肺表现出较高的肿瘤细胞PD-L1阳性表达。并且与其他的驱动基因依赖性肺癌相比,对免疫检查点抑制剂表现出更好的应答。
免疫检查点抑制剂的剂量策略:是最大化生物有效剂量或最大化可耐受剂量
Nivolumab在一项跨多种肿瘤类型的剂量递增研究中被评估,每2周接受0.1-10 mg/kg的剂量(Q2)。所有剂量水平的受体占用情况相似,且观察到的外周趋化因子/细胞因子变化极小。 剂量≥0.3mg/kg时外周受体占位饱和,与化疗或靶向药物相反,未发现最大耐受剂量(MTD),也未发现剂量与特定的≥3级治疗相关不良事件(AEs)之间的关系。 在剂量水平上,我们观察到一个剂量依赖的总体反应率(RR)趋势,即NSCLC的总反应率在剂量维持在≥3mg/kg进入平台,这被作为所有肿瘤的统一推荐的2/3期剂量。 随后的群体药代动力学(PK)之间的数据确定 0.1 -10毫克/公斤 dose-proportional exposures,和falt exposure-response (e -r)的疗效和安全性的关系,240毫克Q2 周 与3毫克/公斤Q2周 的剂量水平上 获益-风险相当,获得食品药物管理局(FDA)和欧洲药品局(EMA)的批准。 最近,更多的PK暴露模拟和多个肿瘤类型的患者数据显示,每4周(Q4W) 480mg暴露和3mg /kg Q2W剂量暴露,风险获益相当。
与此相似的是,pembrolizumab 在剂量爬坡研究中也没有达到MTD (最大耐受剂量),E-R研究提示,在剂量范围为2-10mg/公斤Q3w时,肿瘤退缩反应一致。特定的AE率与剂量增加或暴露无关。从固定剂量的pembrolizumab试验和E-R试验的结果显示,200 mg和2mg/kg Q3w剂量的暴露相似,从而获得了监管批准,最近FDA允许其将剂量调整为每6周(6QW) 400mg。
Atezolizumab 同样没有找到最大耐受剂量MTD,在所有剂量水平(0.01-20mg/kg)均有肿瘤应答,在最佳血药浓度水平研究中找到最适剂量≥10mg/kg,且并没有增加不良安全信号,所以1200mg被作为固定剂量(相当于15mg/kg等效剂量)用以开展临床研究。同样,在剂量,暴露,AE方面没有发现相关性。Durvalumab 几乎重复同样的思路,选定固定剂量 1500mg Q4w。
药代动力学数据和药效与安全性的固定暴露-反应关系报告了与ICI固定剂量和mg/kg剂量相当的风险-收益,从而获得了美国食品药物管理局(FDA)和欧洲药物管理局(EMA)的批准。 然而,应该注意的是,使用ICI的固定剂量而不是个性化的剂量导致患者的体重变异会带来药物剂量超过25%-40%的偏倚,和大约25%药物成本增加。(应考虑不同剂型定价特点),精确的、设计良好的药物经济学研究显然是有必要的。
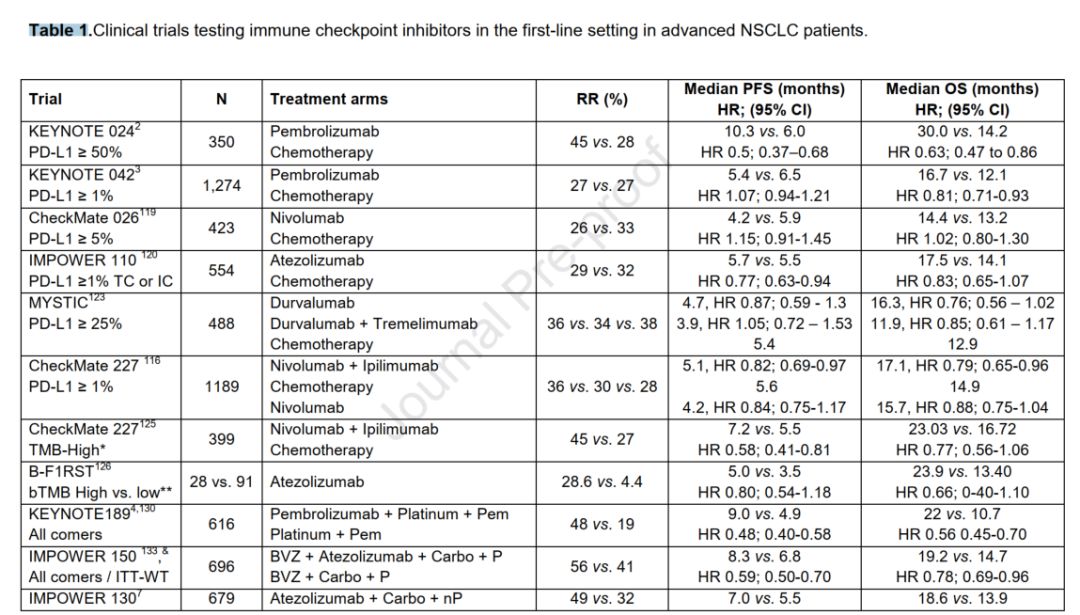
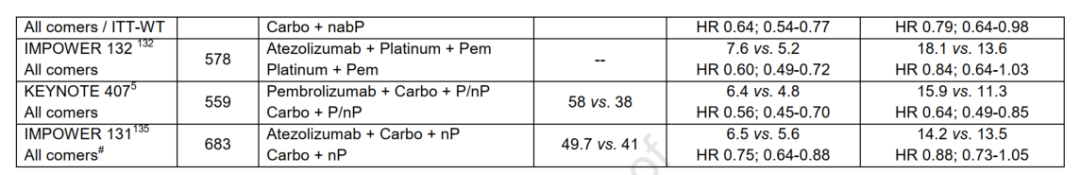
目前,PD-L1高表达(≥50%)是一线NSCLC ICI单药治疗的唯一标准的生物标志物。针对PD-L1,tTMB,bTMB或其他生物标志物对于ICI联合方案的疗效预测作用亟待进一步的设计良好的前瞻性临床研究进行探索,在此之前,需要对选择的cut-off(界值)进行更具体的定义并最大化可重复性。
虽然有证据表明,在晚期NSCLC的一线治疗中,免疫治疗联合化疗优于单纯化疗,且不管PD-L1的表达。但目前尚无证据表明,在PD-L1高表达(≥50%)的患者中,免疫治疗联合化疗优于单纯免疫治疗。在可用药的致癌基因驱动肿瘤中,必须禁止前期使用ICI,对于晚期患者,在没有获得常规基因组信息(EGFR、ALK、ROS1和BRAF)的情况下,不应该使用ICI。
ICI报告称,在PD-L1未被选择的人群中,二线和一线治疗的5年总生存率分别为15%和23%。PD-L1的表达和对ICI的反应是改善预后的因素。在功效-毒性评估后,需要有设计良好的真实世界数据来确认这些结果。
虽然ICD是一个定义明确的现象,但其在控制人类免疫系统中的作用仍不清楚。目前,在临床环境中,在ICI中加入化疗是唯一被证明能够提高NSCLC患者生存率的联合治疗策略。需要更深入地了解ICD诱导剂和ICI组合产生的潜在效益/风险比,并对目前批准的612种抗癌药物进行仔细的免疫学鉴定。
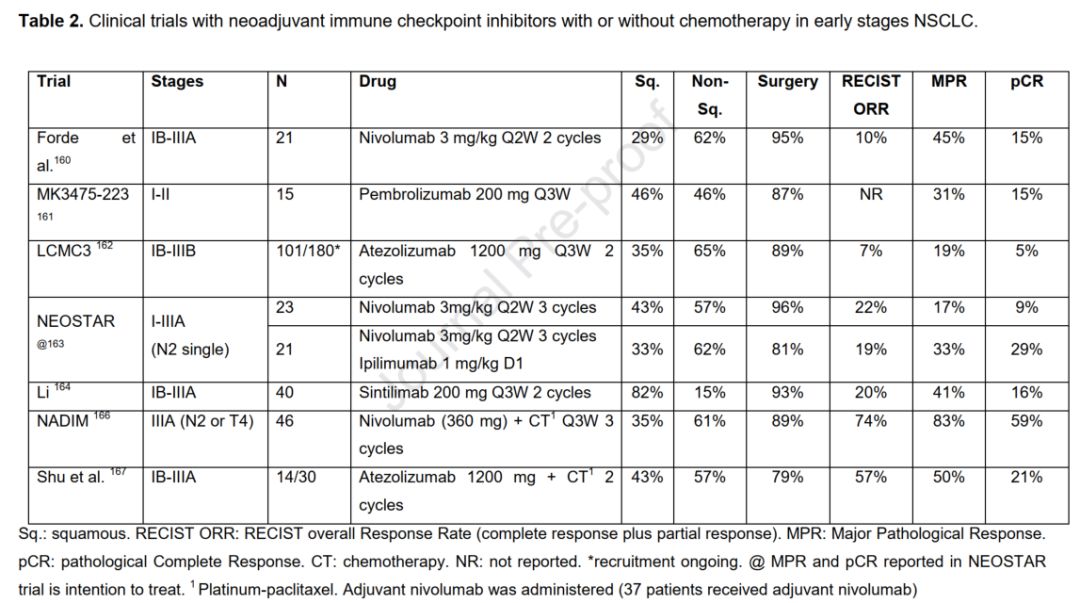
临床前模型提示,与辅助给药相比,新辅助ICI可以显著延长生存并降低肺转移的发生率。包括Forde等人的研究(nivolumab),MK3475-223(I期,pembrolizumab),LCMC3(II期,atezolizumab)以及IONESCO(durvalumab)在内的数项研究已经对NSCLC新辅助ICI的可行性和安全性进行了评估。NEOSTARII期研究探索nivolumab单药或nivolumab联合ipilimumab双药作为早期NSCLC的新辅助治疗策略。最近sintilimab也在相同人群中进行研究评估。这些试验中最具挑战性的发现之一是使用主要病理反应(MPR)作为疗效的潜在替代物,MPR的定义是新辅助治疗后残留≤10%的活肿瘤细胞。MPR此前是用于评估新辅助化疗,但它作为免疫治疗疗效的替代标记物的价值仍然不确定。近年来,制定了病理反应标准以规范免疫治疗的病理评估。在PD-1治疗后评估MPR的肿瘤中,出现PD-1阳性CD8+T细胞的新浸润,这一发现与PD-L1适应性上调机制是一致的。
新辅助ICI研究报告提示MPR率为17%-45%,同时pCR见于5%-29%的病例,但以RECIST标准进行评估的的应答率并不能反映ICI治疗效果,ORR仅出现于7%-22%的病例。值得注意的是,ICI治疗后进展的风险<10%,有90%的肿瘤最终被切除。然而,未报告的IONESCO研究最近由于术后死亡人数过多而停滞。
因为在一些研究中,MPR与PD-L1表达或者TMB并不相关,而在另一些则与之相反,因此PD-L1或者TMB是否为疗效预测标记物仍存争议。最后,联合ICI(例如nivolumab+ipilimumab)的效果是否优于单药治疗仍是未知数,尽管NEOSTAR研究提示联合治疗组的MPR和pCR均高于单药组。
基于转移期的ICI联合化疗的协同效应,相似的联合策略也在早期新辅助模式中进行了探索。
辅助免疫治疗
肿瘤疫苗是早期NSCLC研究最多的基于免疫的治疗策略。不同于进展期肿瘤,在接种疫苗后,强大的免疫逃逸微环境被认为抑制了T细胞介导的免疫反应,然后根治性手术最终可能导致全身免疫抑制分子的释放减少,从而能够在接种疫苗后产生更有效的免疫反应来对抗微小残留。尽管有这一理论基础,即使在早期NSCLC,如MAGRIT试验,癌症疫苗的临床有效性也一直令人失望,这提示目前试验采用的疫苗配方引发的免疫反应太弱,无法在NSCLC中转化为有意义的临床优势。肿瘤手术应激可破坏其他免疫途径,使机体处于免疫抑制状态,这为评估新型疫苗接种策略和术后ICI的有效性提供了依据。
NSCLC完全性切除后辅助治疗的安全性和有效性目前仍未有临床证据。然后黑色素瘤切除后进行辅助ICI是可耐受的,并且延长了DFS。正在进行的III期临床试验正评估NSCLC完全性切除后进行辅助ICI的疗效。在不考虑PD-L1表达情况下,超过4500例术后的IB期-IIIA期NSCLC将会随机进入1年辅助ICI组,安慰剂组以及观察组,随后如果临床需要,则进行辅助化疗。这些Trial最常用的终点是DFS。治疗依从性,缺乏可预测的生物标志物,以及DFS作为主要终点而不是OS,是这些试验的潜在问题。最后,辅助ICI的最佳治疗持续时间相关的治疗并发症以及经济压力也是相关的挑战。
正在进行的针对可切除非小细胞肺癌的靶向治疗和免疫治疗的新辅助研究是一个独特的信息来源,IASLC强烈建议和推动设计和实施一个国际数据库,以收集统一的临床和病理信息,最终目标是促进合作和促进确定长期生存的替代终点。
超进展疾病
超进展疾病(HPD),是一种进展期实性肿瘤在免疫治疗介入后出现快速和恶性的进展模式。HPD是2016年首次见报道,并随后在数种肿瘤类型中被报道,发生频率为3.8%-37.3%。
但是,HPD的定义尚未明确。在所有的研究中,用来定义HPD的主要标准包括肿瘤生长率(TGR)和肿瘤生长动力学(TGK)的变化。临床指标包括治疗失败时间(TTF),肿瘤负荷或者新病灶的出现也见报道。回顾性和异质性研究已经明确了侵袭性PD与不良预后相关,提出了ICI介入后加速PD的假说。
Ferrara等人首次在406例ICI治疗的NSCLC队列中指出HPD的出现,他们定义HPD为超过50%ΔTGR的PD。HPD见于13.8%的患者,且与更差的预后相关。注意,在对照组,化疗组中,HPD为5%,提示这种现象在ICI模式下更常见。Kim等人使用一种独特的定义(TGR,TGK,TTF)评估263名NSCLC患者。TGR/TGK标准下的HPD率为21%,同样与更差的结局相关。注意,基于TTF的定义,HPD率增加至37%。
识别HPD的原因和机制对于在ICI开始前和治疗期间识别易感人群和区分HPD与其他非典型临床反应是至关重要的。不幸的是,目前证据仍不足以实现我们的愿望。Lo Russo等人认为ICI对Fc受体的结合可能转变为以M2样巨噬细胞为主的免疫抑制微环境,但还需要更深入的了解。
其它PD模式,例如快速PD(FP),定义为从基线开始6周内长径总和增加≥50%,以及12周内的early death(ED),已被报道为HPD现象的替代,见于4.7%和5.6%接受atezolizumab治疗的患者。Ferrara等人分析了另外406名患者的FP、ED和HPD。FP/ED见于整个HPD人群中的11%,FP/ED与更具侵袭性的特征和较差的预后相关,提示FP和ED不是HPD的替代品。
探索性研究提出了可预测的生物标志物,但未见临床的、分子的或免疫表型等标志物与HPD明显相关。肿瘤相关标志物,如高肿瘤负荷,某些基因组改变(EGFR改变,STK11突变,MDM2/4扩增),或宿主相关标志物,如外周血细胞(CD8+T记忆淋巴细胞),炎症参数(高DNLR,LDH)和组织微环境(TAM)与HPD有关,但需要进一步的研究证实。
对肿瘤ICI的耐药性进行了转化研究,发现原发性(定义为未出现影像学客观缓解和疗效持续<6个月)和获得性耐受(出现影像学客观缓解和疗效持续<6个月)之间既有不同之处,又有共同的特点。表4概述了迄今报告的应答和耐受的决定因素。

显然,免疫学因素、基因组因素和宿主因素之间在预测ICI耐药性方面的相互作用是复杂的,最终需要一种综合所有这些因素的方法来指导临床决策。
此外,早期检测获得性耐药性的新方法正在开发中。最值得关注的是循环肿瘤DNA的动态变化。通过进一步的验证,这可以加强对无反应肿瘤的治疗(例如,对于PD-L1≥50%的肿瘤,在pembrolizumab的基础上增加化疗),并防止长期暴露在无效治疗下的毒性。
为了合理开发针对肺癌治疗中这一主要问题的联合治疗临床试验,有必要进一步加深对原发耐药和获得性耐药机制的认识。
类固醇激素与疗效的关系
类固醇的假定免疫抑制作用导致每天接受泼尼松≥10毫克的患者被排除在研究ICIs治疗肺癌疗效的临床试验之外。现在累积的证据表明,用于ir-AEs临床管理暂时的、正在治疗中的类固醇,不会对患者的生存结果产生负面影响。相反,在ICIs开始时的基线类固醇是否会降低治疗效果仍然是一个有争议的问题。一项回顾性研究提示,相比于单药ICI治疗初始接受≤10mg的泼尼松的患者,>10mg/day的患者(90/640,14%)的PFS(HR:1.31,p=0.03)和OS(HR:1.66, p=0.001)较差。这些发现与其他报告一致,表明类固醇对存活率有不利影响。然而,真实世界中类固醇激素被广泛用于控制癌症相关的包括呼吸困难,恶液质,乏力以及脑转移等症状,提出了ICI治疗基线的类固醇与潜在预后和/或预测作用的相关性问题。在这种情况下,另一项现实世界的研究最近比较了93/650(14.3%)晚期NSCLC患者每天接受泼尼松>10毫克和≤10毫克的ICIs的疗效,根据类固醇治疗的原因进行分层。分析结果证实了皮质类固醇用于姑息治疗时的不良影响(OS:2.2月vs.11.2月;HR,2.38;95%CI,1.78-3.19;P=0.001),而因癌症相关适应症而接受泼尼松治疗的患者的存活率没有显著差异(10.7 vs.11.2月;HR,0.93;95%CI,0.59-1.48;P=0.77)。这些数据表明,类固醇对ICI疗效的负面影响可能主要与早期姑息治疗的患者预后不良有关。当然,回顾性设计、有限的样本数和人群的异质性限制了任何基于证据的明确结论。
将自身免疫性疾病(AID)患者排除在ICI试验之外是基于临床前模型,该模型表明ICI通路的抑制在AID中发挥作用,并担心潜在的不可接受的免疫激活风险,如AID症状恶化或新的自身免疫表现的发生,以及irAE风险的增加。NSCLC患者中AID患病率为14%,最常见的疾病是类风湿性关节炎、银屑病和多发性肌痛。值得注意的是,最近的一项研究表明,基因预测的AID不是肺癌的危险因素,NSCLC中的AID与肺癌特异性和全因死亡率无关。
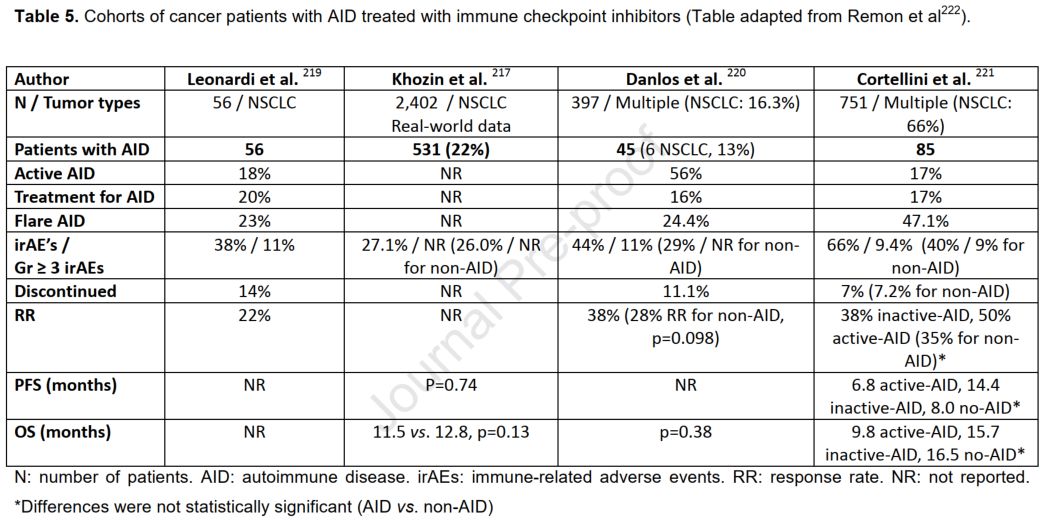
真实世界中,接受ICI治疗的进展期NSCLC中多达22%患有AID。然而,因为这两组患者中都有无症状和没有任何危及生命的aid的患者,如风湿病、皮肤病和内分泌疾病,没有基线的特殊治疗(表5,由Remon等人研究修改),ICI对于伴有AID的肿瘤患者的疗效和安全性证据尚不充分。
患有慢性病毒感染的癌症患者,如乙型肝炎、丙型肝炎(HBV,HCV)或艾滋病病毒(HIV),由于ICIS可能导致宿主免疫平衡失调,经常被排除在ICI临床试验之外,原因是担心疾病爆发。这些具有挑战性的患者群体的临床数据很少,但具有相关性,因为全球丙型肝炎病毒和乙型肝炎病毒的总流行率分别为1.775亿和2.4亿。
评估抗PD-1药物在肝细胞癌的临床研究提示疗效与病毒状态无关,且没有HBV/HCV爆发的病例出现。Tio等人报道14名伴有乙肝的患者(10例恶性黑色素瘤)中,3例对anti-PD1或anti-PD-L1出现ORR,同时,14例丙肝患者有3例也有所反应,且未出现如病毒载量增加之类的非预期毒性反应。另一项前瞻性观察研究显示,在伴丙型肝炎的晚期实体瘤患者中,18例(8%)接受了ICIS治疗,其中包括2例非小细胞肺癌。无一例患者出现丙型肝炎病毒再激活或丙型肝炎病毒相关性肝炎。Byeon等人报道,237例接受anti-PD1治疗的NSCLC患者中,14%伴有HBV感染,ORR为23.1%。ir-AE发生率与非HBV病人相似,但3级及以上肝炎AEs更多见于HBV患者(12.5% vs.1.9%, p=0.0021)。16例慢性肝炎患者中,3例经历了病毒再激活或爆发(unpublished data)。
2017年,有180万人新感染艾滋病毒,艾滋病毒患者仍与癌症风险增加有关。值得注意的是,由于艾滋病毒感染者的全因死亡率下降,艾滋病毒中肺癌的累积发病率正在上升。然而,艾滋病毒患者的肺癌发病率高于对照人群(adjusted IRR 2.38;95%CI;1.61-3.53),可能是由于艾滋病毒感染者的吸烟率较高,几乎是非艾滋病毒感染者的两倍,达到40%。相关的是,在抗逆转录病毒时代,艾滋病病毒感染者的肺癌结果可能会更差,部分原因是治疗差异或可能的宿主因素。
ICI对HIV患者的疗效也是有限的。Cook等人报告了73例伴HIV感染晚期癌症患者的ICIs治疗的系统回顾。62例患者接受抗PD1治疗,6例接受抗CTLA-4治疗,4例接受抗PD1/CTLA-4治疗,1例接受ipilimumab和nivolumab序贯治疗。值得注意的是,NSCLC的总体应答率为30%,黑色素瘤的总应答率为27%,卡波西肉瘤的总应答率为63%,这与之前的研究相似,表明艾滋病毒状况不影响ICIs的疗效。ICIs耐受性良好,70名患者中有6名(8.6%)观察到3级或更高的irAEs,而在28名HIV载量未被检测到的患者中,有26名(93%)仍处于HIV抑制状态。
最近,两项前瞻性研究还显示,在包括NSCLC(表6)在内的晚期肿瘤中,联合使用nivolumab和基于重量的ipilimumab时,没有病毒激活且出现可观的抗肿瘤活性,以及与nivolumab联合使用的安全性可以接受。在HIV患者中,ICI治疗可以增强HIV特异性免疫力,这突出了ICI在慢性病毒感染患者中的潜在治疗益处,对于尽管接受抗逆转录病毒治疗但HIV病毒载量仍持续存在的肿瘤患者,ICI治疗可能提供增强病毒清除的特殊免疫反应(注意:这是慢性病毒感染)。建议进行CD4、CD8监测。
半数NSCLC患者在诊断时年龄超过70岁,15%超过80岁。这部分患者在临床试验中的代表性较低,因此对IO在这些患者中的益处和毒性了解较少。这部分患者在临床试验中的代表性较低,因此对IO在这些患者中的益处和毒性了解较少。在最近的一项关于NSCLC meta-分析,年龄并不能预测ICIs的OS获益(<65 years [HR 0.71] vs. ≥ 65 years [HR 0.69]),。在鳞状非小细胞肺癌的Checkmate171试验中,还报告了在老年患者(≥70岁)中的中位数OS为11.9个月,这与在研究中包括的总体人群中观察到的一致。
从对三项比较pembrolizumab和化疗在PD-L1表达≥1%人群中疗效的随机临床研究(KEYNOTE-010,024,042)的综合分析中发现,对于≥75岁的患者(N=264,132人PD-L1≥50%)而言,相比化疗,Pembrolizumab显著提高了OS(全部PD-L1 ≥ 1的人群: HR=0.76, 95% CI=0.56-1.02; 一线:PD-L1≥ 50% HR, 0.41 [95% CI, 0.23‒0.73]),老年和非老年患者的1年OS率相当。Pembrolizumab治疗的治疗相关AEs较少,ir-AEs的发生率在老年和年轻患者中的频率相当。在Checkmate153 IIIB/IV期研究中,评估Nivolumab用于先前接受治疗的NSCLC患者的疗效,在1426名登记的患者中,39%的患者年龄在70岁或以上,9%的ECOG PS=2。3-5级TRAE(6%-9%)和3级或4级TRAE(12%-14%)的发生率在各亚组和总体人群中相似。总体人群(9.1月)和≥70岁患者(10.3月)的中位OS相似,但ECOG PS=2的患者的中位OS较低(4个月)。
回顾性研究同样揭示了老年患者在真实世界中接受ICI治疗后的效果。在这样一想纳入98例患者的研究(其中27例年龄≥70岁)中发现老年患者PFS和OS短于更年轻的个体。然而,其它控制ECOG评分的真实世界研究发现老年和年轻患者之间的临床结局并无显著性差异。在一项招募了175名患者的研究中,对比老年患者(定义为年龄≥75岁)和非老年患者,发现使用Nivolumab的结果没有差异。在调整年龄后,PS≥2较差的患者的结果也较差。
对于PS评分较好的老年患者而言,ICI应该是值得考虑的,因为对他们来说,获益与风险与较年轻的患者无明显差异。期待这一亚人群的前瞻性临床数据的到来。
既往大量研究显示共生肠道微生物菌群与癌症有着千丝万缕联系,近年来随着免疫治疗发展,越来越多研究也聚焦于肠道微生物菌群紊乱对免疫治疗疗效及毒副反应影响。目前认为肠道微生物菌群可能通过改变局部肠道黏膜及肠道相关淋巴样组织免疫微环境从而影响整体免疫功能,其中经由模式识别受体介导的病原相关分子模式(PAMPs)与抗原呈递细胞及固有效应细胞相互作用可动员适应性免疫反应。此外局部产生的细胞因子及微生物菌群代谢产物同样可影响整体免疫功能,最终这一系列作用机制可通过诱导肿瘤浸润淋巴细胞增多和降低髓源性抑制细胞从而提高抗肿瘤免疫反应。
既然肠道微生物菌群可影响抗肿瘤治疗疗效,那么可导致肠道微生物菌群紊乱的其它治疗方法自然也可能间接影响抗肿瘤治疗疗效。其中抗生素作为一类对菌群有着特殊抑制功能药物自然也成为抗肿瘤免疫治疗研究中重点对象。基于既往多项研究发现治疗前短期内应用抗生素可显著降低应用免疫治疗肺癌患者的无进展生存期和总生存期,当然不可否认的一点是,这里面可能存在应用抗生素患者本身身体状况及更高并发症等因素偏移,但从理论上来说抗生素确实可能通过影响肠道微生菌群从而影响免疫治疗疗效,只是目前仍缺乏更多临床证据去进一步说明抗生素应用剂量和时长对免疫治疗影响,因此临床中对接受免疫治疗的肺癌患者,抗生素使用仍需要权衡对待。
整体而言,肠道微生物菌群可能作为潜在免疫治疗疗效指标已经逐步得到认可,今后还需要进一步探索哪些对免疫治疗更加“友好”的微生菌群并指导相关临床治疗和试验开展。
肠道微生物菌群多样性可作为肺癌免疫治疗有效预测生物标志物,抗生素的应用可能影响免疫治疗疗效,但目前仍需要更多前瞻性及真实世界研究进一步明确它们的临床意义。
小细胞作为恶性程度极高的一类肺癌,近二十年来仍以化疗为主。IMPOWER133和CASPIAN两项III期研究无疑让小细胞肺癌如沐甘霖,首次在一线对阵标准化疗中取得阳性结果,一线免疫联合化疗显著提高2-3个月中位总生存期。但和在非小细胞肺癌不同的是,PD-L1表达水平和肿瘤突变负荷无法预测其联合治疗疗效。对于后线治疗方案,尽管FDA已批准Nivolumab或Pembrolizumab单药作为三线治疗方案,但目前并不支持二线治疗中单独应用免疫抑制剂,Checkmate032的研究显示二线应用Nivolumab联合Ipilimumab与Nivolumab单药相比无总生存差异,仅在回顾性分析中看到肿瘤突变负荷高人群有显著生存获益,仍需要Checkmate331和Checkmate451等大型研究进一步验证,此外针对小细胞肺癌免疫治疗相关生物标志物仍需要进一步探索。
对于广泛期小细胞肺癌,免疫联合化疗已然成为全新治疗方案选择,但就目前而言获益仍然甚微。考虑到小细胞肺癌亚型对免疫治疗不同应答以及免疫治疗短期获益,后续还需要进一步探索新生物标志物以更好指导临床治疗策略选择。对于恶性间皮瘤和胸腺上皮肿瘤,免疫治疗或许能改善整体生存预后,但仍有很长一段路需要走。
鉴于免疫治疗有效率较低,寻找更为合适预测生物标志物是探索免疫治疗重中之重。目前为止,我们已经看到肿瘤突变负荷和PD-L1表达在选择性人群中免疫治疗获益,然而在部分低表达低突变负荷患者也观察到免疫治疗获益的情况,此外,免疫治疗作用机制远比想象中复杂,因此探索免疫治疗相关生物标志物仍道阻且艰。尽管免疫联合化疗带来了更好的临床疗效及“普适性”,但我们仍需要进一步探索更为个体化治疗策略和新联合模式。虽然目前对免疫治疗认知仍处于初级阶段,但基于对肿瘤生物学的深入理解,我们必将探索出一条更为精准免疫治疗之路。
尽管免疫治疗为肺癌患者带来长期生存获益,但原发性和继发性耐药仍不可避免,因此需要新药物或联合治疗策略克服耐药机制。目前克服耐药机制策略主要包括5个方面:
1.靶向PD-1/L1以外免疫检查点
抗肿瘤免疫涉及正向调节因素包括抗原识别,呈递以及T细胞共刺激信号受体激活,以及以免疫检查点为主负向调节因素,目前已有包括像激活共刺激信号受体(OX40,CD40,CD70,ICOS,CD137等)药物以及共抑制信号分子受体(LAG3,TIM3,TIGIT,JAK,STAT3等)抑制剂的研发,相关临床试验正陆续开展。
2.调控微环境“免疫细胞代谢”
包括像经由IDO,CD73等调节色氨酸和腺苷代谢活性从而限制T细胞活化,进而介导免疫耐受,部分药物在与免疫抑制剂联合应用的研究中已显示出初步疗效。
3.靶向DNA损伤修复或下一代疫苗
肿瘤相关疫苗包括树突状细胞疫苗,肽段疫苗,DNA/RNA疫苗及溶瘤性病毒均已有相关研究,鉴于单用疫苗疗效有限,目前主要和免疫检查点抑制剂联合应用开发。
4.工程化T细胞体外扩增及回输
嵌合抗原受体T细胞工程化T细胞中最具代表性范例,当然还有包括肿瘤相关抗原T细胞技术等等,尽管目前这一类技术在实体瘤中的应用仍尚需时日,但部分临床前研究已显示良好应用前景。
5.克服机体“免疫受损”状态
近年来相关研究发现激素和抗生素应用可能影响免疫抑制剂疗效,而其中通过调控微生物菌群可能可以增强固有及适应性免疫。
专家观点
研究者和医药公司应推动包括其它免疫抑制剂靶点药物,免疫代谢相关药物,下一代肿瘤疫苗,工程化T细胞及调节“免疫受损”药物的研发和临床试验开展。
(完结)
本文转自微信公众号:肺癌前沿