- A+

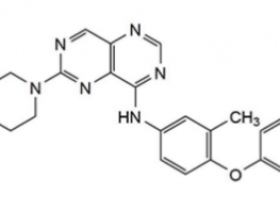
一39岁女性患者,因背痛就诊,脊椎MRI发现L2及L5(第2、5腰椎)有肿瘤病灶,同时L2骨折。PET CT发现左肺上叶65mm占位,纵膈、颈部及肺门淋巴结肿大,伴有肝、右肾上腺、左前脑及骨转移。脑部有局部水肿。液体及组织活检都发现EGFR19del,PDL1表达为阴性。确诊后,患者开始口服阿法替尼(EGFR第2代TKI)治疗,同时配合SBRT(立体定向放疗)治疗脑病灶。
阿法替尼治疗6周后,患者出现左上臂疼痛、水肿及颈部增大。超声显示左侧颈内深静脉血栓形成,第二次扫描证实颈部和左侧锁骨上淋巴结病变加重,伴有新的继发性淋巴结病变。不过,肝转移和肺部原发灶却明显减小,出现了矛盾现象。3周后,患者出现腹痛、厌食及虚弱。MRI显示肝转移灶进展,继发性淋巴结病变增加。从TKI治疗到疾病进展只有2个多月,于是患者再次进行颈部穿刺活检,确认是肺腺癌。确诊时及阿法替尼治疗后进展的NGS活检对比发现,两者都有EGFR扩增,19del及低TMB。不过,第二次活检发现了新的基因异常,包括KIT、FGFR1、PDGFRA、KDR扩增,T790M为阴性。

阿法替尼进展后,患者选择用PD1单抗K药(帕博利珠单抗)联合化疗(培美曲赛+卡铂),同时针对锁骨上及脊椎转移灶进行SBRT。4个治疗周期后,肺部、肝及脊椎病灶都缩小,脑部MRI显示无病灶或新转移。血液检查EGFR突变为阴性。患者继续用K药+培美曲赛维持,截至案例撰写时已经缓解接近了1年。


①肿瘤异质性:在阿法替尼治疗初期,患者不同部位的病灶出现了不同的反应(颈部及锁骨病灶加重,而肺部及肝部病灶缩小),这提示患者的不同部位肿瘤存在一定异质性。基因检测也佐证了这一点,在阿法替尼耐药后检测出了许多继发性突变。
②既往研究显示,无T790M突变的患者,用免疫治疗效果优于T790M阳性的患者。另外,对TKI原发耐药的患者,对PD1的疗效优于TKI有效的患者。
③放疗与免疫的协同作用:放疗对局部肿瘤的治疗效果,可以延伸出全身的远隔效应,激活集体的免疫反应,增强PD1对肿瘤的疗效。既往小编也做过多个研究/个案报道,这里不再赘述。因此,有局部转移的患者,若考虑PD1治疗,可以联合放疗。
④可能是单纯化疗在起效。
⑤放疗、化疗及PD1联合治疗有疗效叠加的作用,当然临床使用时还需要考虑患者的身体情况,避免不良反应带来的严重后果。
2.EGFR突变患者不建议使用PD1,但是可以使用PD1联合方案。在一项研究中使用PD1单抗特瑞普利单抗+化疗治疗EGFR靶向耐药的晚期NSCLC(非小细胞肺癌)患者,结果显示,ORR(客观缓解率)达到了50%。


一62岁男性患者,IIIB期肺腺癌,EGFR19del阳性,术后1年复发,出现右肺门、纵膈淋巴结及多处骨转移。患者先后接受了多种方案治疗,包括培美曲赛+卡铂、替吉奥、厄洛替尼、多西他赛、阿法替尼、在研第三代EGFR-TKI、白蛋白紫杉醇。术后7年,在七线治疗白蛋白紫杉醇失败以后,患者在CT引导下穿刺活检肺部病灶进行活检,发现T790M突变阳性及del19,遂接受奥希替尼治疗。4个月后,疾病再次进展,经支气管镜活检发现EGFR19del及T790M阳性,同时PDL1表达(22C3)高达90%,而手术切除组织的PDL1表达只有25%。

于是,患者接受K药治疗,达到SD(疾病稳定),PFS(无进展生存期)为4个月,之后再接受吉西他滨治疗,达到PR(部分缓解)。


1.EGFR突变患者,在靶向药用尽后,可以穿插化疗来抑制耐药细胞群。若想使用免疫药物,可以在发现PDL1高表达时尝试。靶向、化疗、免疫相互配合,反复攻杀耐药肿瘤,最终做到长期存活。
2.在治疗过程中,有条件时应多次进行组织活检,以便寻找耐药原因,针对性选择下一步治疗方案。
an unusual clinical response to Afatinib and stereotactic radiosurgery in a metastatic
EGFR-mutant NSCLC patient
2.Pembrolizumab and salvage chemotherapy in EGFR T790M-positive non-small-cell lung cancer
with high PD-L1 expression
来源:“找药宝典”, 侵删。