- A+


世界和中国肺癌人群未来2年新增死亡人数变化

肺癌的组织病理学分型及驱动基因突变频率
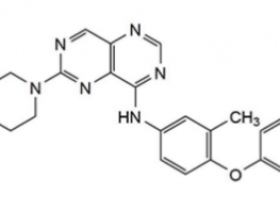
EGFR 突变主要包括4种类型:外显子19缺失突变、外显子21点突变、外显子18点突变和外显子20插入突变。
既往多项研究表明,EGFR 20外显子的体系(Somatic) T790M突变与EGFR-TKIs获得性耐药有关,是耐药突变中最主要的类型。
也有临床研究表明,EGFR 20外显子胚系(Germline) T790M突变同家族性肺癌发病相关,尤其是非吸烟、腺癌患者或肺部表现为多个病灶的家族聚集性患者。

EGFR热点突变及其药物推荐
既往临床报告表明,获得性T790M突变解释了高加索人群和亚洲人群中大约50%的获得性TKI耐药情况。对中国肺癌患者获得性EGFR TKI耐药的研究似乎相对少见,通过对TKI获得性耐药的文献进行总结(见表2),发现:在6项临床研究共1,579例TKI初治患者中,有2.8%(44例)发生T790M突变;而在TKI治疗失败后的NSCLC患者中,有45.4%(54/119)呈T790M阳性。

中国TKI耐药NSCLC患者T790M突变率

NSCLC NCCN 2019.V1指南建议厄洛替尼/阿法替尼/吉非替尼/达克替尼治疗进展的患者进行T790M检测
《2018 CSCO肺癌指南》指出:
(1)欧洲药品管理局2014年9月已批准,当难以获取肿瘤组织样本时,可采用外周血ctDNA作为补充标本评估EGFR基因突变状态,以明确最可能从吉非替尼治疗中受益的NSCLC患者;
(2)CFDA在 2015年2月批准对吉非替尼说明书的更新,补充如下:如果肿瘤标本不可评估,则可使用从血液(血浆)标本中获得的ctDNA进行检测,但特别强调ctDNA EGFR突变的检测方法必须是已经论证的稳定、可靠且灵敏的方法,以避免出现假阴性和假阳性结果;
(3)2018年初厦门艾德的Super-ARMS试剂盒已经获得CFDA的批准,同时可用于组织及ctDNA的基因检测。
其他ctDNA的基因检测方法还包括cobas、微滴式数字PCR(ddPCR)和NGS。
因此,当肿瘤组织难以获取时,血液是EGFR基因突变检测较为合适的替代生物标本,也是对可疑组织检测结果的补充。
2018年9月,发表在中华医学杂志上的《中国非小细胞肺癌患者EGFR T790M基因突变检测专家共识》对EGFR T790M基因突变的相关问题,其中关于检测人群、检测时机、检测标本、检测方法的《共识》如下:
- 【共识1】建议既往接受过EGFR-TKI治疗的局部晚期或转移性NSCLC患者在疾病进展后都应进行EGFR T790M突变检测,建议在影像学进展后考虑T790M检测(1类)。
- 【共识2】建议首先评估患者是否可进行组织活检,如组织可获取,推荐先取组织用于检测T790M突变。检测路径推荐(1类)(见图5)。

T790M基因检测路径推荐
- 【共识3】在组织无法获取时,可考虑采用其他样本比如肿瘤细胞学样本或血浆样本进行EGFR T790M检测(2A类)。
- 【共识4】对于血浆检测阴性的患者,建议密切关注患者的疾病状态,重新评估组织活检的可行性,视情况再行组织或者其他样本的EGFR T790M复测(2A类)。
- 【共识5】针对不同的样本类型和临床需求,建议采用不同的检测方法,推荐对血浆样本采用敏感度较高的方法进行检测(2A类)。
恶性肿瘤被认为是一类多基因遗传疾病,遗传因素在其中起到了重要作用。胚系突变是指遗传性基因缺陷是通过卵子和/或精子传递的。临床研究显示,胚系EGFR p.T790M突变是一种弱致癌突变,其存在证明有部分患者可能在出生时就成为了肺癌的高危患者。
肺癌中EGFR突变主要集中在胞内段编码结构域(外显子18~21),主要突变包括 :19 外显子的缺失突变(delE746A750)、21 外线子点突变(L858R)、18 外显子点突变(G719X)和 20 外显子插入突变。
EGFR基因上最常见的体细胞激活突变赋予肺癌EGFR-TKI敏感性。然而,尽管患者对EGFR-TKI有初始反应,所有患者最终都会产生耐药性。最常见的耐药机制之一是在外显子20处获得第二个突变-p.T790M突变(见图6)。
既往研究病例大多数是通过体细胞突变获得耐药性,但也有少数报道属于胚系EGFR p.T790M突变,其在非小细胞肺癌病例中有1%的发生率。基于现有肺癌家族获得的数据研究表明,胚系EGFR p.T790M突变是一种肺癌家族主要的癌症易感基因突变,不吸烟携带者估计有31%的肺癌风险。

EGFR基因酪氨酸激酶结构域
多项研究表明,散发性EGFR激活突变偏好从不吸烟和女性肺癌患者。 而KRAS突变是吸烟的肺腺癌中出现的主要驱动突变,与EGFR突变相互排斥,所以吸烟携带者中的胚系T790M突变和KRAS突变也可能是相互排斥的。因此,胚系携带者中的第二次激活EGFR突变可能在从不吸烟者和女性中更频繁地出现并且易于癌症发展(见图7)。

在有和没有种系T790M突变的患者中,NSCLC患者假设的突变驱动发展途径
据报道,接受TKI治疗的唯一胚系病例是 Tibaldi et,al报道的两个姐妹(PubMed: 21252721),对TKI治疗部分回应。因此,在没有其他已知或疑似分子靶点的情况下,常规化疗似乎是该类肺癌患者首选的一线治疗方案。目前几种新的第三代、第四代TKI已进入临床试验,有些是为了克服T790M突变介导的耐药性而设计,可在将来提供有效靶向治疗的可能性。
有研究发现,定期CT扫描是携带者早期发现肺癌的一种方法。然而,胚系T790M突变携带者的最佳管理和预防策略需要更多的案例观察,从预防和治疗中获得更多的信息,因此Dana-Farber癌症研究所启动了“INHERIT EGFR研究:调查T790M的遗传风险”。
胚系T790M突变导致一种非常罕见且独特的肺癌遗传综合症,偏好从不吸烟的女性,从不吸烟携带者发生肺癌的风险大于有或没有突变的重度吸烟者。携带胚系T790M突变的非癌人群,不论其吸烟状况如何都会增加患肺癌的风险,随后应加强监测,包括低剂量CT扫描等。

2. 《NCCN Guidelines Version 1.2019 Non-Small Cell Lung Cancer》
3. 《2018 CSCO 肺癌指南》
4. Gou LY et al. Prevalence of driver mutations in non-small-cell lung cancers in the People's Republic of China.Lung Cancer (Auckl). 2014 Feb 12;5:1-9.
5. Lee Y, Shim HS, Park MS, et al. High EGFR gene copy number and skirashas predictive markers for EGFR tyrosine kinase inhabitors in patients with advanced squamous cell lung carcinoma. J Clin Cancer Res, 2012, 18(6): 1760-1768.
6. Jemal A, Siegel R, Ward E, et al. Cancer statistics, 2007. J CA Cancer J Clin, 2007, 57(1): 43-66.
7. Sullivan R , A latise OI, A nderson BO, et al. Global cancer surger y: delivering safe affordable, and timely cancer surgery. J Lancet Oncol, 2015, 16(11): 1193-1224.
8. Jacobsen K,Bertran-Alamillo J,Molina MA,et al.Convergent Akt activation drives acquired EGFR inhibitor resistance in lung cancer.J Nat Commun,2017,8( 1) : 410.
9. Lou Y,et al.Germline Mutation of T790M and Dual/Multiple EGFR Mutations in Patients With Lung Adenocarcinoma. Clin Lung Cancer. 2016 Mar;17(2):e5-11.
10. Hu Y,et al.Discrimination of Germline EGFR T790M Mutations in Plasma Cell-Free DNA Allows Study of Prevalence Across 31,414 Cancer Patients.Clin Cancer Res. 2017 Dec 1;23(23):7351-7359.
11. Gazdar A,et al.Hereditary lung cancer syndrome targets never smokers with germline EGFR gene T790M mutations.J Thorac Oncol. 2014 Apr;9(4):456-63.
12. Tibaldi C, Giovannetti E, Vasile E, et al. Inherited germline T790M mutation and somatic epidermal growth factor receptor mutations in non-small cell lung cancer patients. J Thorac Oncol. 2011; 6:395–6.