- A+
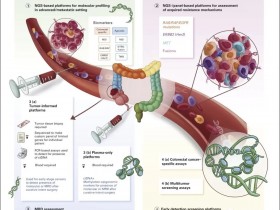
免疫治疗疗效预测的分子标志物检测现状
自2014年9月FDA加速批准第一个PD-1免疫检查点抑制剂用于二线治疗黑色素瘤以来,至今已有5个PD-1/PD-L1抑制剂(帕博利珠单抗、纳武利尤单抗、阿特珠单抗、Avelumab和Durvlumab),共获批用于非小细胞肺Ca、尿路上皮肿瘤等12种实体瘤和所有微卫星高不稳定性(MSI-H)实体瘤的二/三线甚至一线治疗。免疫治疗已成为继靶向治疗后,肿瘤治疗领域的重要进展。特别是对于没有靶向驱动基因变异及治疗靶点的患者,免疫治疗的出现给他们带来了新的希望。同时,临床研究表明,肿瘤患者一旦响应免疫治疗,往往能带来长期的获益,甚至是疾病的完全缓解。
然而,目前仍然没有一种非常有效的单一针对PD-1/PD-L1抑制剂疗效预测的分子标志物。 FDA批准用于指导免疫治疗患者筛查的biomarker中, PD-L1表达阳性患者的免疫治疗有效率仍然很低(除淋巴瘤外,客观缓解率ORR介于10%~40%)。
对于MSI-H实体瘤而言,PD-1/PD-L1抑制剂治疗的有效率达到53%,但由于除子宫内膜肿瘤、胃腺肿瘤和结直肠肿瘤外,MSI-H实体瘤尤其是晚期实体瘤,占所有实体瘤中比例较低,获益的患者有限。

不同早期和晚期实体瘤的MSI-H患者比例
同时,研究表明肿瘤突变负荷(TMB)是一种预测PD-1/PD-L1抑制剂治疗的重要标志物,然而高TMB(TMB-H)患者的客观缓解率也仅有约30%。TMB联合PD-L1预测PD-1/PD-L1抑制剂效果也并不理想(ORR介于20%-75%)。

TMB-H和PD-L1 High非小细胞肺Ca的PD-1抑制剂有效率
PD-L1蛋白表达反映的是肿瘤组织中潜在的PD-1/PD-L1药物作用靶点,而MSI-H和TMB-H一定程度上能反映患者肿瘤新抗原的数量。为什么PD-L1表达阳性和TMB-H的患者响应PD-1/PD-L1抑制剂仍不理想呢?研究发现其中部分原因可能和肿瘤的免疫微环境有关,当中最重要的是肿瘤浸润淋巴细胞(TILs)的状态相关,只有在有浸润淋巴细胞存在的情况下,新抗原才能体现出免疫原性。
有研究根据TILs的存在与否,将肿瘤分为所谓的“冷肿瘤”和“热肿瘤”,简而言之,热肿瘤是有浸润淋巴细胞的肿瘤,而冷肿瘤则相反。“热”和“冷”反映的是肿瘤是否有免疫原性。
同时通过PD-L1表达和TILs这两个标志物,将实体瘤分为4种类型(肿瘤免疫浸润分型,TMIT),分别为TMIT I~IV。其中以CD8A mRNA表达和CYT1(GZMA、PRF1mRNA表达)反映TILs。

实体瘤的免疫分型
显而易见,冷肿瘤的PD-1/PD-L1抑制剂的有效率可能较低(TMIT II和IV型),而热肿瘤中PD-L1高表达的肿瘤(TMIT I型)更有可能响应PD-1/PD-L1治疗,同时TMIT I型的患者可能有更多的肿瘤新抗原。
对14种实体瘤的分析表明,同一种肿瘤的4种分型的比例不相同,不同肿瘤的4种分型的比例也不一样,如对于皮肤黑色素瘤(SKCM),I~IV型的比例分别为37%、32%、3%和28%。

不同肿瘤的4种TMIT分型的比例
如果以肿瘤新抗原来对4种免疫分型的的PD-1/PD-L1抑制剂响应情况进行分类,会发现14种肿瘤中有8种(肺鳞肿瘤、肺腺肿瘤、膀胱肿瘤、乳腺肿瘤、宫颈肿瘤、结直肠肿瘤、胃肿瘤和皮肤黑色素瘤)的I型与新抗原增加相关,因此以上类型的肿瘤的TMIT I型更可能从抗PD-1/PD-L1治疗中获益,并从侧面证实了TMIT分型的有效性。
通过TILs和PD-L1进行分型的思路也经过了伊匹单抗(anti-CTLA4)治疗黑色素瘤的验证,CD8+ IHC阳性和PD-L1阳性的患者响应治疗的情况更好。
然而,TMIT I型不同患者中,TILs的细胞类型和功能状态并不相同。同一患者不同时间TILs也并不是一成不变的,TILs的mRNA和蛋白表达会受疾病治疗等的影响,肿瘤免疫微环境的异质性影响了不同患者对免疫治疗的响应。
研究分析TILs不同类型细胞对免疫治疗的影响,CD3+和CD8+ TILs与非小细胞肺Ca、黑色素瘤等实体瘤更好的临床获益相关,然而只有CD8是一个独立的预后因素。而FOXP3+调节性T细胞等与免疫获益负相关。临床研究证实PD-L1表达阳性的TILs响应阿特珠单抗治疗。
有研究发现,T细胞的受体中免疫检查点抑制、T细胞primed、炎症反应等相关基因的表达,T细胞受体克隆性等也与免疫获益相关。
同时,TILs细胞类型、T细胞受体的克隆变化、肿瘤放化疗后的新抗原变化等都能反映免疫微环境动态变化的一部分,这些都能反映肿瘤对免疫治疗的响应。

免疫治疗非响应者可转化为响应者
免疫微环境的变化,可能会使原本并不响应免疫治疗的患者,变为响应治疗。而如何筛选这类患者,或者如何改变免疫微环境使之响应免疫治疗,是扩展免疫治疗应用范围、并提高免疫治疗有效率的免疫治疗研究的重要方向。
多个研究表明放化疗后,肿瘤会产生更多的突变以及肿瘤新抗原;经伊匹单抗治疗耐药后,TILs增多(CD8、CD4表达上升)的肿瘤更容易响应抗PD-1/PD-L1治疗。
该发现可以解释此前免疫治疗在多种实体瘤中的二线/三线治疗中的效果较好,即多线治疗后,可能会有部分“冷”肿瘤转化为了“热”肿瘤。然而,免疫治疗能否替代放化疗等的一线治疗呢?免疫治疗联合其他疗法成为肿瘤一线治疗研究的重要手段。
目前免疫治疗联合化疗和多个免疫抑制剂联合治疗(如纳武利尤单抗联合伊匹单抗)正在进行多个临床试验。如Keynote189试验已证实了帕博利珠单抗联合培美曲塞+卡铂/顺铂,相比安慰剂+培美曲塞和卡铂/顺铂,在未治转移性非鳞非小细胞肺Ca中,无论是PFS还是OS,均有极大的提升(12个月OS率69.2% vs 49.4%;中位PFS8.8个月 vs 4.9个月)。


帕博利珠单抗联合化疗的OS和PFS好于化疗
同时Keynote189的结果还表明,PD-L1表达<1%的分组,免疫联合化疗的OS和PFS也好于化疗,虽然PD-L1强阳性的患者获益最高。值得注意的是,另一个IMpower150试验中,基于PD-L1、CXCL9和IFNγ等免疫相关基因表达的分型,对阿特珠单抗治疗的预测效果最好,这显示免疫微环境的相关基因同样可以指导免疫联合治疗。
基于蛋白表达(免疫组化等检测)、mRNA表达(RNA-seq等检测)等多组学的免疫微环境相关的分子标志物已经在进行研究,如基于CD8A mRNA表达或CD8免疫组化的TILs水平联合PD-L1蛋白表达水平可更好地筛选响应免疫治疗的患者。
IFNγ等炎症反应相关基因、PD-1、PD-L1、PD-L2等免疫检查点相关基因、GZMB等T细胞primed相关基因的表达也开始在多个临床研究中,预测抗PD-1/PD-L1治疗的有效性。
由于免疫微环境的动态变化,如果能在治疗过程中,连续监测免疫微环境相关的分子标志物,可能对于免疫治疗耐药以及假性进展等有指导作用。如在阿特珠单抗的一个I期临床试验中,在血浆中发现了IL-18、ITAC和CD8+HLA-DR+Ki67+ T细胞的上升。另外,血浆CD8+PD-1+ T细胞表达也是一个潜在的非小细胞肺Ca抗PD-1治疗的分子标志物。

目前基本所有的免疫治疗分子标志物都是在治疗前进行疗效预测,如果能像靶向用药监测一样,在免疫抑制剂治疗过程中进行无创检测和监控,其前景将会非常广阔。
- 参考文献
[1].George Cyriac, Leena Gandhi. Emerging biomarkers for immune checkpoint inhibition in lung cancer. Semin Cancer Biol. 2018 May 19. pii: S1044-579X(17)30250-X.
[2].L. Gandhi, et al. Pembrolizumab plus Chemotherapy in Metastatic Non–Small-Cell Lung Cancer. N Engl J Med. 2018 May 31;378(22):2078-2092.
[3].W. Joost Lesterhuis, et al. Dynamic versus static biomarkers in cancer immune checkpoint blockade: unravelling complexity. Nat Rev Drug Discov. 2017 Apr;16(4):264-272
[4].Dung T. Le, et al. Mismatch-repair deficiency predicts response of solid tumors to PD-1 blockade. Science. 2017 Jul 28; 357(6349): 409–413.
[5].Carbone DP, et al. First-Line Nivolumab in Stage IV or Recurrent Non-Small-Cell Lung Cancer. N Engl J Med. 2017 Jun 22;376(25):2415-2426.
[6].Yu-Pei Chen, et al. Genomic Analysis of Tumor Microenvironment Immune Types across 14 Solid Cancer Types: Immunotherapeutic Implications. Theranostics. 2017; 7(14): 3585–3594.
[7].Galon J, et al. Towards the introduction of the 'Immunoscore' in the classification of malignant tumours. J Pathol. 2014 Jan;232(2):199-209.
[8].Paul C. Tumeh, PD-1 blockade induces responses by inhibiting adaptive immune resistance. Nature. 2014 Nov 27;515(7528):568-71.
[9].Kathleen M. Mahoney, Combination cancer immunotherapy and new immunomodulatory targets. Nat Rev Drug Discov. 2015 Aug;14(8):561-84.
[10].Pei-Ling Chen, Analysis of Immune Signatures in Longitudinal Tumor Samples Yields Insight into Biomarkers of Response and Mechanisms of Resistance to Immune Checkpoint Blockade. Cancer Discov. 2016 Aug;6(8):827-37.