- A+
CD30和PD-1是经典霍奇金淋巴瘤(cHL)的两种理想的治疗靶点。CD30抗体-药物偶联物(ADC)brentuximab vedotin以及PD-1抗体nivolumab和pembrolizumab对治疗复发性/难治性cHL非常有效。随着新型靶向治疗制剂的出现,传统化疗和放疗治愈率可能升高,长期毒性可能降低。霍奇金淋巴瘤(HL)约占淋巴瘤的10%,诊断年龄呈双峰分布。根据形态学和HRS细胞分型,HL可分为经典HL和结节性淋巴细胞优势型霍奇金淋巴瘤(NLPHL),后者约占霍奇金淋巴瘤病例的5%。cHL中,特征性HRS细胞是巨大的单核细胞(霍奇金细胞)或多核细胞(Reed-Sternberg细胞),具有显著的嗜酸性包涵体样核仁。
HRS细胞产生各种细胞因子,通过这些细胞因子,HRS细胞与周围免疫细胞相互作用以驱动其自身增殖和存活,并调节宿主反应。NLPHL中,HRS变异细胞称为淋巴细胞优势型(LP)细胞,通常CD15和CD30呈阴性,CD20呈阳性。生物学不同,cHL和NLPHL的治疗策略不同。标准一线治疗,如ABVD(阿霉素、博莱霉素、长春碱、氮烯咪胺)或BEACOPP(博来霉素、依托泊苷、阿霉素、环磷酰胺、长春新碱、甲苄肼、泼尼松)联合放疗时,大多数cHL患者可以治愈。然而,约10%早期和30%晚期cHL患者一线治疗后出现复发或一线治疗失败后发生难治性疾病,仅1/2的患者可以通过高剂量治疗(HDT)和自体干细胞移植(ASCT)后化疗治愈。直至10年前,二线治疗后复发的cHL患者仍明显缺乏有效的治疗选择。近年来,出现了多种新型cHL疗法。
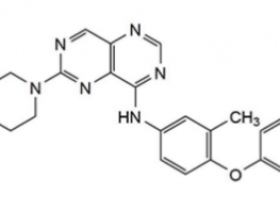
CD30抗体-药物偶联物(ADC)brentuximab vedotin以及PD-1抑制剂nivolumab和pembrolizumab显著改变了cHL治疗格局。Brentuximab vedotin与HRS细胞表面的CD30结合,并通过内吞作用内化至细胞内。然后分离抗CD30抗体中的细胞毒性MMAE并中断有丝分裂。
CD30靶向治疗
CD30是肿瘤坏死因子(TNF)受体超家族成员。健康个体中,CD30表达局限于活化B和T细胞的一小部分。cHL中,CD30在HRS细胞上高表达,并且是理想的治疗靶点。然而,cHL中的多种非偶联抗CD30单抗活性最小,且原因尚不清楚。一种可能的机制是CD30结合后细胞杀伤力不足。另一方面,mAb免疫毒素偶联物在HL中可能活性有限。
双特异性抗体
双特异性mAb免疫治疗在某些实体瘤和血液恶性肿瘤治疗中取得了部分成功。有效治疗方法包括catumaxomab(EpCam阳性胃肿瘤和卵巢肿瘤)和blinatumomab(CD19阳性急性淋巴细胞白血病)。
20世纪90年代,Hartmann及其同事研发了靶向CD30和CD16的鼠双特异性Ab HRS-3/A9。20世纪90年代后期研发了另一种靶向CD30和CD64的双特异性mAb H22xKi-4。最新研发的颇具前景的靶向CD30和CD16A双特异性抗体为嵌合双特异性mAb AFM13。
CD30 CAR-T细胞
CD30是HL CAR-T细胞免疫治疗颇受欢迎的靶标。最近,Baylor研究者公布了7例HL和2例ALCL患者CD30 CAR-T细胞I期研究。结果显示持久CR,CD30 CAR-T细胞输注前肿瘤切除和淋巴细胞减少可进一步增强其临床活性。
PD-1靶向免疫治疗
HRS细胞产生抑制T细胞介导的免疫应答的分子。HRS细胞上表达的PD-L1与T细胞上表达的PD-1结合,诱导免疫检查点抑制作用,并引起T细胞耗竭。
另外,Avelumab是一种全人源化抗PD-L1单克隆抗体。应用avelumab阻断PD-1检查点对治疗复发或难治性HL有效。JAVELIN HOGKINS I期研究中,治疗耐受性良好;ORR为54.8%,两例完全缓解(CR)(6.5%)和15例部分缓解(PR)(48.4%)。所有给药组均观察到反应,ORR范围为14.3-83.3%,与nivolumab和pembrolizumab相似,但是仍需进一步的研究。
- 参考文献
[1].Diefenbach CS, et al. Hodgkin lymphoma: current status and clinical trial recommendations. J Natl Cancer Inst. 2017;109(4):djw249.
[2].Yucai Wang, Grzegorz S. Nowakowski, Michael L. Wang and Stephen M. Ansell.Advances in CD30- and PD-1-targeted therapies for classical Hodgkin lymphoma.Journal of Hematology & Oncology2018.