- A+

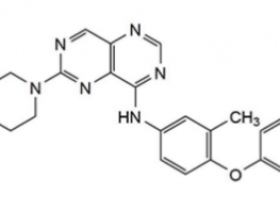
近期,世和基因参与浙江省肿瘤医院胸部肿瘤内科余新民教授团队的一项临床研究,应用世和基因全景416泛肿瘤基因检测panel,对69例晚期EGFR敏感突变阳性肺腺肿瘤患者配对的肿瘤DNA(FFPE或胸水来源)和血浆cfDNA进行检测,结合临床结果分析观察EGFR突变患者分子层面的复杂性和异质性。结果显示,两种样本对于EGFR敏感突变的检测结果一致性高达87%,再次证实了基于NGS的液态活检可以作为组织检测的有效补充;此外,研究还发现其他基因的变异如CDC73, SMAD4, RB1 和PIK3CA是EGFR-TKI的潜在耐药机制。该研究成果被国际著名期刊Lung Cancer(IF=4.5)接收发表。
目前,携带EGFR敏感突变的晚期非小细胞肺Ca(NSCLC)患者一线治疗标准首选EGFR-TKIs,包括一代、二代、三代EGFR TKIs。既往的多项临床研究显示一代EGFR-TKI针对EGFR L858R和19Del的ORR约为70%-80%,中位PFS约为10个月,均优于传统含铂双药化疗。然而,在实际的临床实践中仍有约10-20%携带EGFR敏感突变的NSCLC患者对EGFR-TKIs治疗响应较差。越来越多的证据表明,EGFR敏感突变患者的基因异质性可能影响EGFR-TKIs治疗的临床疗效及患者预后。
该研究共纳入69例晚期NSCLC患者,均携带EGFR敏感突变且使用了一代EGFR-TKIs进行治疗,预后信息完整。借助世和基因416 panel对患者的FFPE样本和外周血cfDNA样本进行检测,在FFPE样本中共检测到200个actionable变异,而在血浆cfDNA中共检测到140个actionable变异。在该群患者中,除了EGFR敏感突变之外,还涉及到其他33个共存基因变异,其中频率最高的是TP53突变,其次是少见/罕见EGFR突变、EGFR扩增,RB1突变等(图1)。
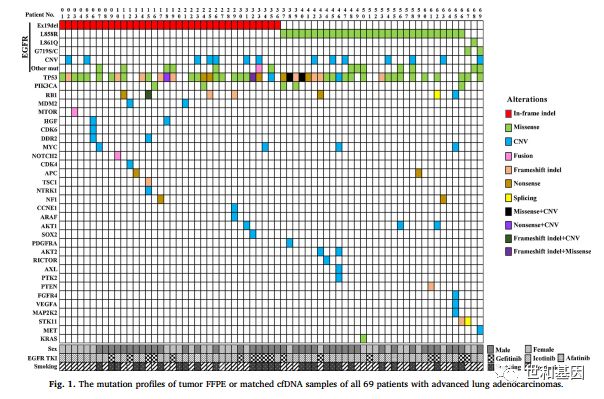
图1. 69例患者FFPE样本和配对血浆cfDNA样本的突变图谱
该69例患者的FFPE样本和血浆cfDNA样本中EGFR敏感突变的一致性为87%,cfDNA检测的敏感性和特异性分别为88.2%和100%,这也再次证实了血浆样本是组织突变检测的有效补充。研究者进一步对除EGFR敏感突变外其他不同突变类型在cfDNA与组织DNA中的一致性进行了对比分析,发现错义突变的一致性为65.5%;基因融合变异一致性为66.7%;无义突变一致性为75%;移码突变和剪切突变一致性均为50%。但是CNV变异更多的在FFPE样本中检出,和cfDNA一致性仅为27.5%;有意思的是对于EGFR扩增,组织样本和cfDNA样本的一致性为57.1%,远高于其他基因的拷贝数变异(图2)。
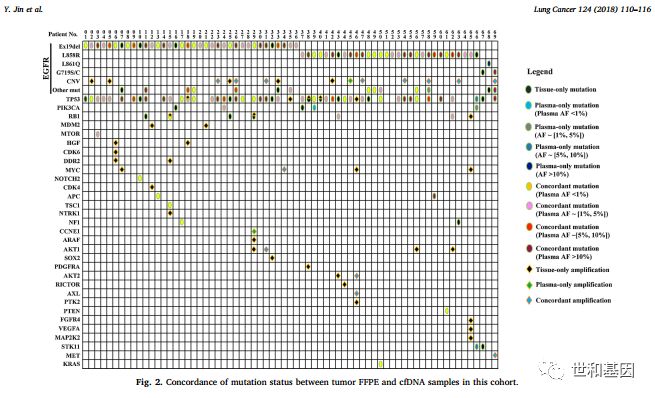
图2. FFPE样本和配对血浆cfDNA样本基因突变一致性分析
为了探究EGFR-TKIs原发耐药的机制,该研究进一步比较了使用一代EGFR-TKIs治疗Short PFS(< 6 months, n=15)和Long PFS(>12 months, n=17)两组患者治疗前组织基因突变图谱的差异,。在15个Short PFS患者中,潜在的原发耐药机制有PIK3CA 突变 (n=3); AKT1 基因扩增 (n=2); HGF 基因扩增(n=1); NRAS 突变 (n=1);其他7个患者携带有其他一些具体意义未知的变异也可能与EGFR-TKIs的原发耐药机制相关(图3)。
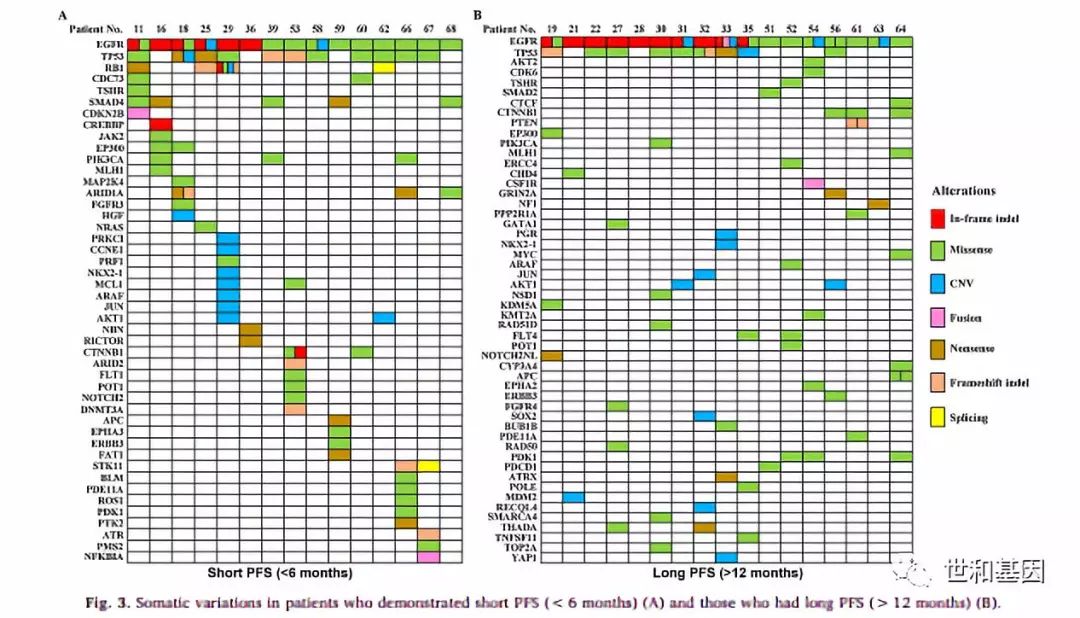
图3. Short PFS组和Long PFS组患者体细胞基因突变差异
研究者进一步将两组患者的基因突变在KEGG数据库中进行信号通路的富集分析,仅Short PFS组患者涉及到的信号通路异常包括:
(1)免疫相关的信号通路:Toll样受体信号通路,T细胞受体信号通路;
(2)EMT相关信号通路:TGF-β信号通路;
(3)EGFR下游信号通路:PIK3CA / AKT / mTOR信号通路;
(4)细胞功能相关途径:错配修复信号通路,AMPK信号通路,TNF信号通路,Notch信号通路和肿瘤中的转录失调信号通路。
这些结果表明EGFR-TKIs原发耐药机制存在高度的异质性,异常复杂,需要更多的功能研究进一步探索。
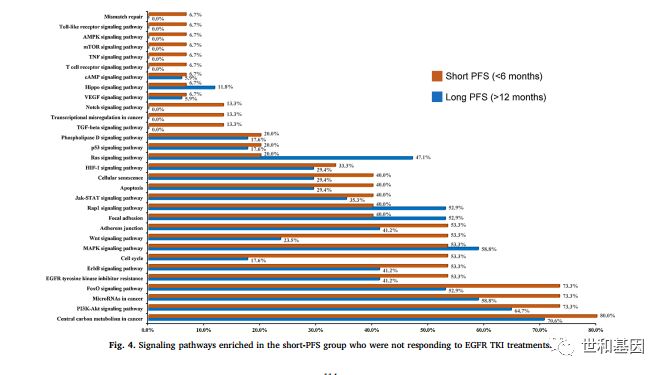
图4. 两组患者基因突变相关信号通路分析比较
总体来说,该研究使用NGS平台对晚期EGFR敏感突变NSCLC患者进行全面的突变分析,揭示了该群患者分子层面的复杂性和异质性,并探索了导致EGFR-TKIs原发耐药的可能机制。此外,该研究再次证实了NGS相较于传统方法在EGFR突变检测方面的优势,通过检测更多的突变位点和其他伴随的突变基因,可帮助我们进一步了解和预测患者药物治疗的疗效及可能的耐药机制,实现个体化治疗,从而促进肺Ca精准医疗发展。
Ying Jin, Xun Shi, Jun Zhao, et al. Mechanisms of primary resistance to EGFR targeted therapy in advanced lung adenocarcinomas. Lung Cancer, 2018.
https://doi.org/10.1016/j.lungcan.2018.07.039