癌症免疫治疗给很多患者带来了新生,但让人遗憾的是,相同的疗法通常因人而异。例如,PD-1(programmed death 1)或PD-L1(programmed death ligand 1)的抗体已被批准用于超过25种不同的肿瘤,但PD-1-PD-L1阻断的响应率从13%到69%不等,具体取决于肿瘤的类型【1-2】。为了制定使更多患者受益的治疗策略,人们致力于探究调节PD-1抑制剂响应的因素。研究表明,粪便微生物群移植可以改善黑色素瘤患者anti-PD-1治疗的效果【3-4】,然而,粪便移植引起的增强效应是不一致的,肠道菌群如何促进抗肿瘤免疫仍不清楚,这阻碍了菌群相关疗法的临床转化。
2023年5月3日,来自美国哈佛医学院的Arlene H. Sharpe团队、Dennis L. Kasper团队与Gordon J. Freeman团队合作在Nature杂志上在线发表了题为Targeting PD-L2–RGMb overcomes microbiome-related immunotherapy resistance的文章,研究人员发现免疫疗法是否能有效发挥抗癌效果,与肠道内的数万亿微生物有着密切关系:特定的肠道细菌通过下调免疫分子PD-L2和RGMb的表达、活性及其相互作用,进而增强PD-1检查点阻断治疗效果。该研究为增强免疫疗法效力、改善患者预后提供了重要线索。
首先,作者构建了肠道菌群增强免疫治疗的小鼠模型(图1a):在小鼠皮下植入MC38结肠癌细胞,含有小鼠肠道微生物组的SPF(specific pathogen-free)小鼠对anti-PD-L1治疗有响应,无菌(germ-free, GF)小鼠对anti-PD-L1或anti-PD-1治疗没有响应;用健康的人类微生物群(HMB)或健康的小鼠微生物群重建GF小鼠,可以促进anti-PD-L1治疗的强抗肿瘤反应(图1b);用四种口服抗生素的混合物(ABX)抑制肠道菌群也可以阻止anti-PD-L1或anti-PD-1介导的MC38肿瘤生长抑制(图1c)。
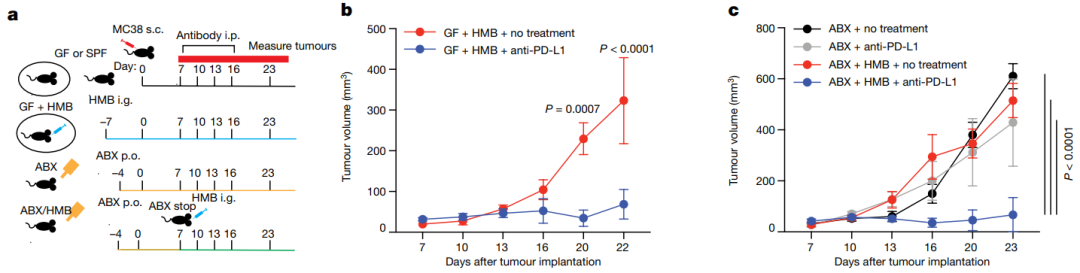
图1. 微生物群促进对PD-L1阻断的有效抗肿瘤反应。a.小鼠肿瘤模型构建示意图;b.给予HMB的GF小鼠中有或没有anti-PD-L1治疗的MC38肿瘤生长;c.给予HMB的ABX小鼠中有或没有anti-PD-L1治疗的MC38肿瘤生长。
随后,作者想知道肠道细菌如何影响抗肿瘤免疫反应。通过比较几种免疫检查点分子在抗生素治疗小鼠和ABX/HMB处理小鼠的肿瘤、肿瘤引流淋巴结(dLN, draining lymph nodes)和肠系膜淋巴结(MLN, mesenteric lymph nodes)免疫细胞上的表达,作者发现参与检测和破坏癌细胞的各种免疫细胞有明显差异,表明肠道菌群的差异影响了免疫细胞的行为,从而改变对免疫疗法的响应。对免疫疗法有良好反应的小鼠,肠道菌群会让抗原呈递细胞上的PD-L2表达维持在较低水平。为了确定与anti-PD-L1介导的抗肿瘤反应相关的特定细菌种类,作者进行了抗生素选择、选择性培养基和测序分析,鉴定出了两种细菌:Coprobacillus cateniformis和Erysipelatoclostridium ramosum,并证实它们可以增强anti-PD-L1介导的抗肿瘤反应。但进一步分析发现,只有C. cateniformis可以在体内和体外下调树突状细胞(DCs)上的PD-L2表达。
接下来,作者探究了C. cateniformis是否通过下调PD-L2表达来影响免疫功能。用C. cateniformis处理骨髓来源的树突状细胞(bone-marrow-derived dendritic cells, BMDCs)可以促进体外促炎CD8+ T细胞反应增加,相反,用C. cateniformis处理过表达PD-L2-GFP的BMDCs则没有类似变化,表明C. cateniformis的免疫调节作用可以被PD-L2过表达所抵消。随后的体内体外实验显示,C. cateniformis的抗肿瘤作用取决于DCs上PD-L2表达的下调,C. cateniformis治疗不能独立于PD-L2下调增强抗肿瘤免疫力。
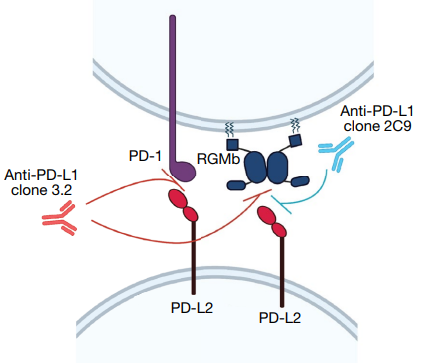
最后,作者鉴定了PD-L2的分子伙伴RGMb。PD-1和PD-L2的联合阻断比单独的PD-1阻断提供更好的抗肿瘤反应,提示PD-L2效应是由PD-1以外的受体介导的。作者因此检测了阻断PD-L2-PD-1相互作用或PD-L2-RGMb相互作用对于促进PD-L1阻断的抗肿瘤反应是否必要(图2),发现阻断PD-L2与RGMb的相互作用足以促进对PD-1或PD-L1阻断的抗肿瘤反应。随后,作者评估了anti-RGMb单克隆抗体和anti-PD-L1或anti-PD-1联合给药对GF小鼠MC38肿瘤的影响:当给予anti-PD-L1或anti-PD-1时,anti-RGMb显著抑制了肿瘤的生长,表明RGMb阻断足以诱导抗肿瘤反应。为了了解肠道微生物群如何调节RGMb-PD-L2相互作用,作者比较了SPF和GF小鼠MC38肿瘤中RGMb的表达,发现GF小鼠CD8+肿瘤浸润T细胞中Rgmb的转录水平比SPF小鼠高出6.1倍,RGMb蛋白表达水平也显著高于SPF小鼠,表明某些肠道微生物会抑制RGMb在T细胞上的表达。进一步分析显示,RGMb通过抑制T细胞活性影响抗肿瘤免疫力。
图2. PD-L2与PD-1或RGMb结合以及阻断抗PD-L2抗体特异性的示意图。抗PD-L2克隆3.2阻断PD-L2-PD-1和PD-L2-RGMb相互作用。抗PD-L2克隆2C9仅阻断PD-L2-RGMb相互作用。
总的来说,作者通过研究微生物组依赖的小鼠癌症模型的免疫反应,鉴定了微生物群促进anti-PD-1和anti-PD-L1治疗响应的新机制,即肠道微生物组下调PD-L2及RGMb表达以促进抗肿瘤免疫,并鉴定了介导这种影响的特定细菌种类。该研究确定了PD-L2-RGMb途径的下调是肠道微生物群促进对PD-1检查点阻断响应的特定机制,阻断PD-L2-RGMb相互作用联合anti-PD-1或anti-PD-L1治疗可以克服微生物组依赖性对PD-1通路抑制剂单药治疗的耐药性,为治疗PD-1癌症免疫治疗无反应的患者提供了新的治疗策略。同时,该研究提出了一种创新的方法,即使用肠道微生物组作为发现平台来确定新的癌症免疫治疗靶点。
https://doi.org/10.1038/s41586-023-06026-3
1. Ribas, A. & Wolchok, J. D. Cancer immunotherapy using checkpoint blockade. Science 359, 1350-1355 (2018).
2. Zhao, B., Zhao, H. & Zhao, J. Efficacy of PD-1/PD-L1 blockade monotherapy in clinical trials. Ther. Adv. Med. Oncol. 12, 1758835920937612 (2020).
3. Baruch, E. N. et al. Fecal microbiota transplant promotes response in immunotherapy-refractory melanoma patients. Science 371, 602-609 (2021).
4. Davar, D. et al. Fecal microbiota transplant overcomes resistance to anti-PD-1 therapy in melanoma patients. Science 371, 595-602 (2021).
本篇文章来源于微信公众号: BioArt