- A+
早筛网讯:近日,一项正在进行的前瞻性研究的最新数据发表在《英国癌症杂志》上,这些数据进一步验证了液体活检领域领先企业Inivata的RaDaR(微小残留病灶和复发)液体活检测试的性能,得益于此,Inivata计划于今年实现RaDaR的商业化。
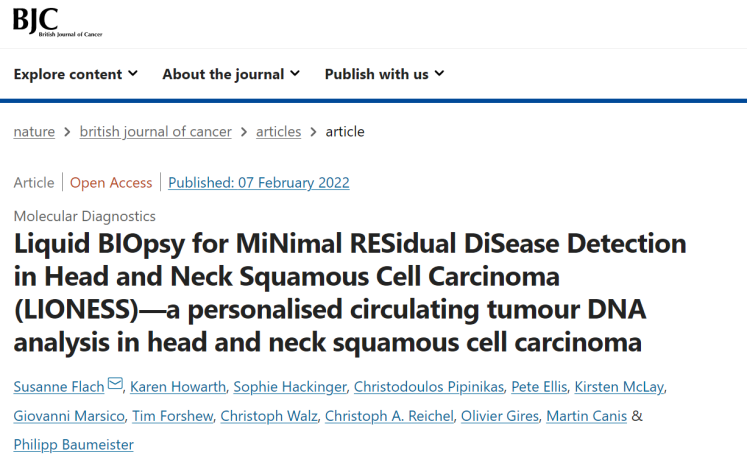
https://doi.org/10.1038/s41416-022-01716-7


研究结果对RaDaR和MRD检测领域意义重大
在LIONESS研究中,Inivata通过RaDaR对17名患者——一个小队列的血液样本中的循环肿瘤DNA(ctDNA)进行检测。其中,个性化定制的Panels被设计用于检测34至52个体细胞突变,中位数为48个体细胞突变。
研究显示,这17名患者均患有III期或IVb期的P16阴性HNSCC,并曾接受意向性根治术。
研究人员称:“对于P16阴性的患者,最初的诊断以及对HNSCC的监测完全基于临床发现和具有敏感性和特异性警告的影像学结果。”
Inivata公司的首席医疗官David Eberhard在接受采访时表示:“P16阴性的HNSCC患者的预后往往比P16阳性的患者更差,而且,P16阴性的患者复发‘相当快’,因此能够早期识别那些复发风险更高的患者并使他们尽早接受治疗相当重要。”
简而言之,P16阴性的HNSCC患者有着“相对较大或局部晚期”肿瘤,早期复发风险十分高,因此Inivata认为他们是“可以从ctDNA早期检测MRD中获益”的人群。
此外,Eberhard表示:“在ctDNA检测水平低至百万分之六的五名临床复发患者中,RaDaR被证明具有100%的敏感性。迄今为止,所有的复发都是在病情进展前通过ctDNA检测出来的,比正常检出复发时间提早了108天到253天。其余12名患者没有检测到复发,这表明RaDaR的临床特异性为100%。”(编者按:样本量有点小,期待后续大样本数据)

虽然现有的数据展现了RaDaR的潜在好处,但ctDNA监测是否可以成为一种额外的工具来帮助辅助治疗或临床随访分层,还需要进行干预性研究来确定。
即便如此,“这些发现对RaDaR和更广泛的MRD领域都有着重大意义,”Eberhard表示,“对于MRD领域来说,这个结果是‘非常有希望的’,因为它表明在病人最初的治疗之后,MRD检测对这一人群的最终临床复发具有‘高度的预测性’。对于RaDaR测试来说,高度的临床敏感性和特异性表明,在最后一次随访时RaDaR能够区分出复发的患者和没有复发的患者。”
Eberhard还表示:“高敏感性的ctDNA检测能够在ctDNA含量低至0.01%突变变异等位基因频率(VAFs)时检出ctDNA。而在LIONESS研究中,RaDaR能够检测到VAF水平为0.0006%的ctDNA。在该研究队列中,20%的MRD阳性患者的ctDNA水平低于0.01%,这表明RaDaR能够检测到那些被敏感性不高的测试遗漏的MRD阳性患者,最大化避免漏检。”

商业化提上日程,RaDaR有望被纳入医保
此次发表在BJC上的成果是RaDaR 2022年的第一项研究。Eberhard表示:“未来还会有许多不同的研究数据,涵盖HNSCC和其他肿瘤类型,在今年不同的肿瘤学会上发布。”
目前,RaDaR只用于临床试验。而这项研究的数据有助于推动RaDaR的进一步商业化。Inivata正计划在“不久的将来”实现RaDaR的商业化,使其用于临床。
“要成功实现RaDaR的商业化,纳入医保以便患者能够负担得起是关键所在,”Eberhard说,“Inivata已经向医疗保险和医疗补助服务中心(CMS)的MolDx项目的医疗保险管理承包商Palmetto GBA提交覆盖RaDaR的初步申请,预计在下个月收到回复。”
Inivata首席执行官Clive Morris补充说道:“Inivata尚未披露提交医保覆盖的适应症类型,但包括HNSCC、肺癌和乳腺癌在内的一系列的适应症是有数据支撑的。未来,Inivata将继续积累数据来证明RaDaR在不同适应症中的价值,并将致力于扩大RaDaR的报销范围以及临床使用范围。”
根据去年年底Palmetto GBA发布的癌症MRD检测测试的“最终本地覆盖决定”来看,RaDaR很有希望被纳入医保。

MRD领域方兴未艾,
未来将有最佳方式预测临床复发
在监管许可方面,
本篇文章来源于微信公众号: 早筛网