- A+
"
2021年3月6日,第18届中国肺癌高峰论坛于广州召开,会议上达成了我国首个《肺癌分子残留病灶专家共识》,共识中指出MRD的检测,需稳定检出丰度≥0.02%的ctDNA。为什么是0.02%?而不是0.01%?0.02%到底是什么意思?是site水平还是sample水平?
MRD,即微小残留病灶(Minimal Residual Disease),在实体肿瘤中常指分子残留病灶(Molecular Residual Disease),因为基于ctDNA分子层面的MRD评估可提供预后和预测的指导信息。
2021年3月的肺高论坛上,吴一龙教授发表了《肺癌分子(微小)残留病灶(MRD):共识和争鸣》的演讲,并在最后的总结部分介绍了专家们讨论后达成的五点MRD共识。
2021年3月-2021年10月期间,此共识并未公开发表,也尚未进行细节描述。针对共识中提及ctDNA-MRD的NGS检测技术标准需稳定检出丰度≥0.02%的ctDNA,大家更是仁者见仁智者见智,为什么是0.02%?而不是0.01%?0.02%到底是什么意思?是site水平还是sample水平?
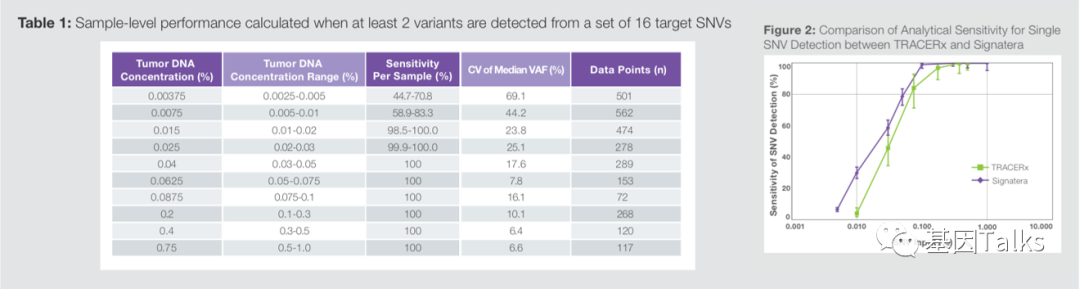
为什么是0.02%?而不是0.01?小编此前也找了很多文献,有文献指出,早期肿瘤的肿瘤分数(TF)较低,中位数约为0.02%(ctDNA TF),只有ctDNA-MRD LoD≥0.02%才能保持一定的MRD检测灵敏度(0.1% LoD将会漏检44% I期患者及10% IV期患者),1 所以,猜测0.02%可能是这么由来的。但这并非官方的回答。

当然,还有很多关于早期肿瘤(约1cm3)ctDNA丰度的研究报道,有0.006%,0.008%,还有0.01%的,但均无法匹配0.02%这个数字。
近日,《非小细胞肺癌分子残留病灶专家共识》(下文简称《MRD共识》)发表于《循证医学》杂志,首次公开回答了0.02%的缘由。2

*参与《MRD共识》编写的基因检测(精准医疗)公司有燃石,世和,吉因加,桐树,至本和艾德
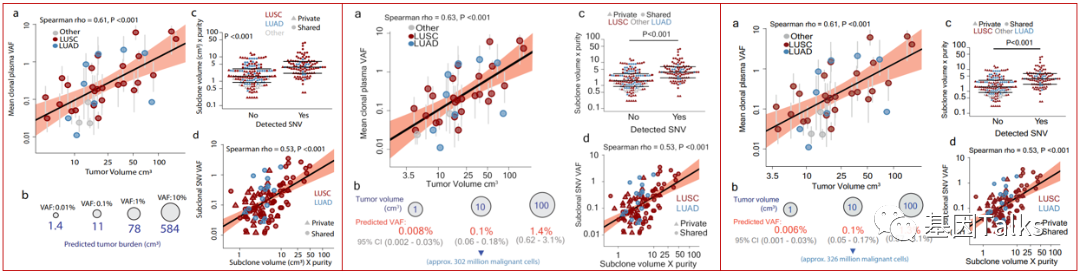
《MRD》共识指出:根据既往研究结果提示, 早期NSCLC患者血浆中位cfDNA浓度为7.69 ng/mL,3 换算在10 mL血浆【意味着至少20ml全血】中含有则大概含有20 000个单倍体基因组(3.3 pg); 考虑到cfDNA建库时的损耗以及至少存在2条相同的变异基因序列, 10 mL血浆中ctDNA检测到的极限分子信号即为0.02%的水平【意味着20ml全血检测到的极限为0.02%】。另外, 从TRACERx研究数据推算, 在1 cm3体积的肿瘤情况下, 10 mL血浆中大概含有2条肿瘤来源DNA分子。4 因此, 在NSCLC中进行MRD检测时, 该检测方法必须可稳定检测出丰度≥ 0.02%的ctDNA。

从《MRD共识》对0.02%的要求来看,我们不难看出,其前提是10ml血浆(即至少2管10ml全血),检测到丰度0.02%也是site水平(注意,没说是site水平一定要稳定检出,随机检出亦可),但site水平稳定检出0.02%难度非常大,所以想稳定检出0.02%,又引入了sample水平的概念,即检测足够多的位点数,同时又尽可能提高每个位点的灵敏度(每个位点上尽可能的测到0.02%),综合广度和深度,进而达到稳定检出≥0.02%(sample水平,Netera技术策略)。当然,如果site水平能做到稳定检出0.02%最好。
因此,sample水平稳定检出≥0.02%是可行。如果经过验证site水平检出0.02%的灵敏度能达到20-30%,那么设计的sample水平检测灵敏度基本能达到100%,甚至只需要1管10ml全血(约4-5ml血浆,33ng的cfDNA)。当然,血浆量越多,单点的灵敏度越高,对于MRD和I/II类基因变异的检测就越好。
所以0.02%既可以是site水平,也可以是sample水平,看具体什么技术方法和策略。
此外,《MRD共识》对共识级别进行了划分,五点共识的级别等级都不是很高,仅为2A或2B级,即基于低水平证据,仅供临床参考。这也从侧面说明了MRD的检测目前仍处于“摸着石头过河”的前期探索阶段,有待国内各家肿瘤基因检测(精准医疗)公司共同努力,发表高水平证据,进一步提高和完善MRD应用专家共识,给临床带来更大的获益。

▼ 完整《非小细胞肺癌分子残留病灶专家共识》







参考资料:
1.Zviran, A., Schulman, R.C., Shah, M. et al. Genome-wide cell-free DNA mutational integration enables ultra-sensitive cancer monitoring. Nat Med 26, 1114–1124 (2020).
2.吴一龙, 陆舜, 程颖, 周清华, 王长利, 王绿化, 黄诚, 韩宝惠, 宋启斌, 陈晓媛, 刘安文, 范云, 陈明, 刘伦旭, 陈椿, 宋勇, 董晓荣, 揣少坤, 汪笑男, 易鑫, 严令华, 王维锋, 朱冠山, 张绪超, 杨帆, 钟文昭, 闫小龙, 徐松涛, 刘志刚, 袁智勇, 谢聪颖, 朱波, 崔久嵬, 柳菁菁, 杨衿记, 周清, 杨学宁, 张嘉涛, 中国抗癌协会肺癌专业委员会, 广东省临床试验协会/中国胸部肿瘤研究协作组. 非小细胞肺癌分子残留病灶专家共识. 循证医学, 2021,21(3): 129-135.
3.ABBOSH C, BIRKBAK N J, SWANTON C. Early stage NSCLC-challenges to implementing ctDNA-based screening and MRD detection[J]. Nat Rev Clin Oncol, 2018, 15(9): 577-586.
4.ABBOSH C, BIRKBAK N J, WILSON G A, et al. Phylogenetic ctDNA analysis depicts early-stage lung cancer evolution[J]. Nature, 2017, 545(7655): 446-451.
本篇文章来源于微信公众号: 基因Talks